
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
量子力学的原子结构模型中,用了四个量子数来描述原子核外电 子运动状态:主量子数n、角量子数l、磁量子数m、自旋磁量子数ms。 这四个量子数所表达的含义可以简单地归纳如下:
(1)主量子数n:电子层的编号。
由离核最近到较远,电子层依次为第1个电子层、第2个电子层、 第3个电子层……所以n的取值为正整数1,2,3,…,第1电子层、第2 电子层、第3电子层……又常用指定符号表示为:K层、L层、M层、N 层、O层、P层、Q层……这样更简便。
电子之间的主量子数n的不同,既可表示电子离核距离又可表示其能量的不同。但每个电子层并非一个有固定半径的轨道,而是离核距离在一定数值区间内的一个区域,所以一般情况下,n越大,表示电子离核的平均距离越远,能量越高。
(2)角量子数l:能级编号(或称之为电子亚层编号)。
主量子数为n的某电子层内,总是有n个能级。某电子层内的各能级编号时,为避免与其主量子数n的编号重复,规定按离核由近到远的顺序,依次称为第0能级、第1能级、第2能级……即L的取值为从0 开始的整数0,1,2,3,•••,(n-1),也常用更简便的指定符号表示为s能级、p能级、d能级、f能级、g能级……
多电子体系中,主量子数n相同的电子,若角量子数l不同,也既可表示电子离核距离又可表示其能量的不同。各个能级也并非一个有固定半径的轨道,而是离核距离在一定数值区间内的一个区域。n相同时,一般情况下,l越大表示电子离核的平均距离越远、能量越高。 具体例如:M层(n= 3)有3个能级,分别为s能级(l= 0)、p能级(l= l)、d能级(l= 2)。电子离核的平均距离依次变远、能量依次变高。
它同时决定该能级内的原子轨道(或原子轨道的电子云)的形状, 分别是l= 0时的s轨道,呈球形分布;l=1的p轨道,呈哑铃形或纺锤形分布;l= 2的d轨道,呈花瓣形分布。
(3)磁量子数m:原子轨道的编号。
角量子数为l的某能级内,总是有2l+1个原子轨道。也是为了避免编号重复,规定角量子数为l的某能级内各原子轨道的编号分别 为一l,— (l-1),•••,一2,一1,0,+ 1,+2,•••,+(l-1),+l。
主量子数n相同,角量子数l也相同的电子,若磁量子数m不同, 是否表示电子离核距离以及其能量的不同呢?并不是。
原子轨道的磁量子数m是按照在人为建立的三维坐标系中的原子轨道伸展方式的不同而分别赋值的。具体例如:某p能级(l = 1)中, 有2l+1= 3个原子轨道,其磁量子数m分别为-1、0、+ 1。这三个原子轨道的示意图分别如下。
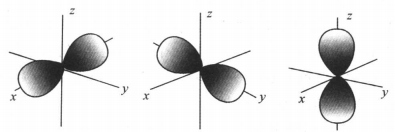
为了更明晰地表达在人为建立的三维坐标系中的原子轨道伸展方式的不同,对以上p能级的三种特定伸展方式的原子轨道更常用px、py、pz来表示,即给能级符号加上与伸展方式相关的右下角标。由此可见,n相同l也相同而m不同的电子,其所处原子轨道仍然并非一个有固定半径的轨道,仍是离核距离在一定数值区间内的一个区域,而且电子所处原子轨道离核的平均距离可能相同。
同一能级中不同的原子轨道的能量在无磁场时并没有区别,而在有磁场时有着细微的差别。具体表现如:某种激发态锂原子,当其电子 由L层p能级跃迁回L层s能级时,若无磁场作用,只会产生一条谱 线;若有磁场作用,就会产生离得较近的三条谱线。由此大家可以理解为什么该量子数称为磁量子数。需要说明的是,在以后的学习中,一般 不考虑磁场作用,所以,量子数n相同、角量子数l也相同,而磁量子数m不同的电子,其能量是相同的。
(4)自旋磁量子数ms:电子的自旋运动方式。
任意原子轨道中,电子的自旋运动状态都有两种,并且是相反的。
其自旋磁量子数叫分别规定为+ 1/2、-1/2,符号分别是↑、↓。至于电子的自旋运动方式究竟是怎样的,仍在探索之中,大家不必深究。
由以上内容,大家可以简单地归纳出,在主量子数n、角量子数l、磁量子数m、自旋磁量子数ms这四个全面描述原子核外电子运动状态的量子数中:仅由主量子数n、角量子数l、磁量子数m即可完整地指示电子的空间运动状态,即空间运动区域,并且电子的运动并不存在确定半径的轨道;仅由主量子数n、角量子数l即可判断电子能量的大小。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【导读】第一电离能(I)和第一电子亲和能(E)从能量变化的角度描述了同一个过程的正反两...
电离能和电子亲和能都是研究元素游离态的原子的性质。电离能是衡量元素金属性大小的物...
硼,元素符号B,价电子构型2s 2 2p 1 ,第二周期第ⅢA族。 作为非金属,最高氧化数对...
多电子原子中,在考虑某个电子时,可以把其他电子对其排斥作用看作削弱了原子核对它的...
1.核外电子共有几个能层? 能层电子层,根据离原子核远近的不同,由里向外可分为第一、二...
1.一个电子的运动状态要从哪几个方面描述? 答:应从这个电子所处的能层(电子层)是第...