
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.利用守恒思想计算
【例1】碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
①方法1:45~50℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2Cl2·3H2O,该反应的化学方程式为___________。
②方法2:先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。
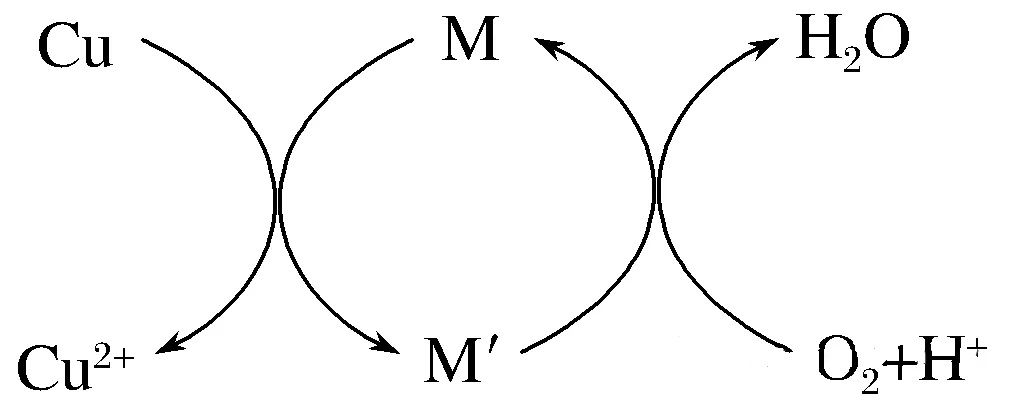
M′的化学式为________。
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。为测定某碱式氯化铜的组成,进行下列实验:①称取样品1.116 0 g,用少量稀HNO3溶解后配成100.00 mL 溶液A;②取25.00 mL 溶液A,加入足量AgNO3溶液,得AgCl 0.172 2 g;③另取25.00 mL 溶液A,调节pH 4~5,用浓度为0.080 00 mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-===CuY2-+2H+),滴定至终点,消耗标准溶液30.00 mL。通过计算确定该样品的化学式。
[解题思路] 守恒1:由得失电子守恒可得:4CuCl+O2+8H2O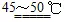 2[Cu2(OH)2Cl2·3H2O]
2[Cu2(OH)2Cl2·3H2O]
守恒2:由电解质溶液中电荷守恒可得:
n(Cl-)=n(AgCl)=4.800×10-3mol
n(Cu2+)=9.600×10-3mol
n(OH-)=2n(Cu2+)-n(Cl-)=1.440×10-2mol
守恒3:由质量守恒可得:n(H2O)=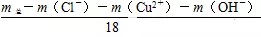 =4.800×10-3mol
=4.800×10-3mol
解析 (1)①反应物为CuCl、O2和H2O,生成物为Cu2(OH)2Cl2·3H2O,根据电子守恒和原子守恒配平。②由图示Cu+M→Cu2++M′,说明Cu被m(氧化);M′+O2+H+→M+H2O,说明M′被氧化为M,说明M价态高,由题信息“Fe3+对该反应起催化作用”,M为Fe3+,M′为Fe2+。
(2)n(Cl-)=n(AgCl) ×100.00 mL ÷25.00 mL=0.172 2 g ÷ 143.5 g·mol-1×100.00 mL÷25.00 mL=4.800×10-3mol
n(Cu2+)=n(EDTA)×100.00 mL ÷ 25.00 mL=0.080 00 mol·L-1×30.00 mL×10-3L·mL-1×100.00 mL÷25.00 mL=9.600×10-3mol
n(OH-)=2n(Cu2+)-n(Cl-)=2×9.600×10-3mol-4.800×10-3mol=1.440×10-2mol
m(Cl-)=4.800×10-3mol×35.5 g·mol-1=0.170 4 g
m(Cu2+)=9.600×10-3mol×64 g·mol-1=0.614 4 g
m(OH-)=1.440×10-2mol×17 g·mol-1=0.244 8 g
n(H2O)= (1.116 0 g -0.170 4 g-0.614 4 g-0.244 8 g ) ÷18 g·mol-1 =4.800×10-3mol
A∶B∶C∶X=n(Cu2+)∶n(OH-)∶n(Cl-)∶n(H2O)=2∶3∶1∶1
答案:(2)①4CuCl+O2+8H2O 2[Cu2(OH)2Cl2·3H2O] ②Fe2+
2[Cu2(OH)2Cl2·3H2O] ②Fe2+
(2)Cu2(OH)3Cl·H2O
[解决方案]
1.三大守恒思想

2.电子守恒解题的思维模板

特别提醒:对于多步连续进行的氧化还原反应,只要中间各步反应过程中没有损耗,可直接找出起始物和最终产物,删去中间产物,建立二者之间的电子守恒关系,快速求解。
【对点训练】
1.(转移电子守恒)
(1)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为________。(计算结果保留两位小数)。
答案:1.57
(2)用KClO3氧化3 mol 的VO2+变为VO2+,则需要氧化剂KClO3至少为________ mol。
答案:0.5
2.(电荷守恒)
为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为________。
答案:2
3.(质量守恒)
(1)LiPF6产品中通常混有少量LiF。取样品Wg,测得Li的物质的量为n mol,则该样品中LiPF6的物质的量为________ mol(用含W、n的代数式表示)。
答案:(W-26n)/126
(2)在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41 g,CO2的体积为1.344 L(标准状况),则钴氧化物的化学式为________。
答案:Co3O4
2.利用方程式之间的关系计算
【例2】水中溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I-还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O32-+I2===2I-+S4O64-)。
问题:取100.00 mL 水样经固氧、酸化后,用a mol·L-1Na2S2O3溶液滴定,以淀粉溶液作指示剂,若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为________ mg·L-1。
[解题思路] 根据反应过程确定关系式
过程 | 对应反应 |
氧的固定 | 2Mn(OH)2+O2===2MnO(OH)2 |
MnO(OH)2还原为Mn2+ | MnO(OH)2+2I-+4H+===Mn2++I2+3H2O |
滴定过程 | 2S2O32-+I2===2I-+S4O64- |
关系式:O2~2MnO(OH)2~2I2~4Na2S2O3 | |
答案:80ab
【例3】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系。在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
回答下列问题:
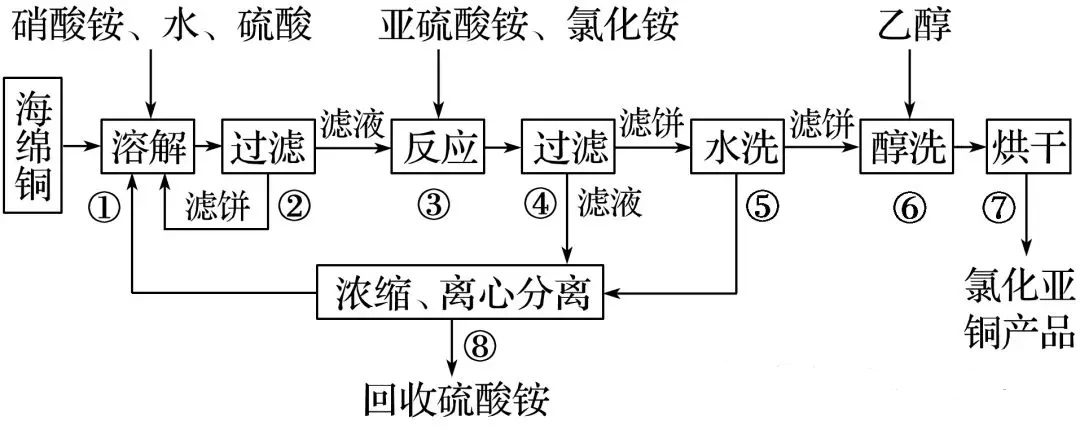
准确称取所制备的氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+。样品中CuCl的质量分数为________。
[解题思路] 依据信息确定关系式
由
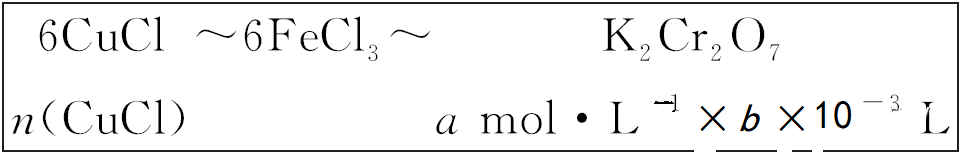
答案 :59.7ab /m %
[解决方案] 利用关系式法解题的思维模板

【对点训练】
4.ClO2易溶于水,用水吸收ClO2得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL 试样;量取V1mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
(已知2Na2S2O3+I2===Na2S4O6+2NaI)
原ClO2溶液的浓度为________ g/L(用步骤中的字母代数式表示)。
答案:135cV2/V1
5.实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。
问题:若用16.3 g 软锰矿(含MnO2 80%)进行上述实验最终生成的KMnO4与Na2C2O4反应,则消耗Na2C2O4的物质的量为________。
提示:①软锰矿制备K2MnO4的化学方程式
3MnO2+6KOH+KClO3 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
②K2MnO4制备KMnO4的化学方程式3K2MnO4+2H2SO4===MnO2↓+2KMnO4+2K2SO4+2H2O
③KMnO4能与经硫酸酸化的热Na2C2O4反应生成Mn2+和CO2的化学方程式是2KMnO4+5Na2C2O4+8H2SO4===K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O
解析:根据反应方程式,找出关系式:
3MnO2~3K2MnO4~2KMnO4~5Na2C2O4
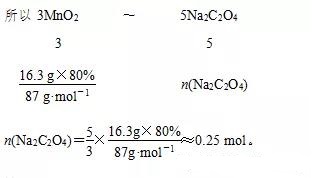
答案:0.25 mol

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、钒及其化合物 VB族元素钒(3d 3 4s 2 )的存在形式变化很多。 一是价态的变化,化合...
...
1.增大原料浸出率(离子在溶液中的含量多少)的措施:搅拌、适当升高温度、延长浸出时...
一、目的(分离提纯、生产制备) 1.使某些金属离子形成氢氧化物沉淀,或防止某些金属离...
硫代硫酸钠的工业制法: (1)亚硫酸钠 将纯碱溶解后,与(硫磺燃烧生成的)二氧化硫作用...
第一种——酸浸 1 、定义: 是指是用无机酸的水溶液作浸出剂的矿物浸出工艺。它是化学...