
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在基于真实情境考查学生综合运用知识的能力的考试理念引导下,与化工生产关系密切的催化剂备受青睐,成了热门考点。从考查的知识看,主要从反应历程、活化能、速率、平衡移动等角度考查催化剂对反应的影响。从试题形式上看,常常融合图像、表格等信息呈现形式,考查学生吸收和整合陌生信息的能力。
一、催化剂与反应历程
催化剂如何影响化学反应?有一个熟悉的例子:Cu催化乙醇的氧化反应。
2Cu+O2 2CuO
2CuO
CH3CH2OH+CuO 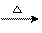 CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
催化剂Cu先参与反应后又重新生成,它经历了Cu→CuO→Cu的变化历程。
[例1] 用NaClO3、H2O2和稀硫酸制备ClO2。反应开始时加入少量盐酸,ClO2的生成速率大大提高(Cl-对反应有催化作用)。该过程可能经两步反应完成,将其补充完整:
①________________(用离子方程式表示);
②H2O2+Cl2===2Cl-+O2+2H+。
[解析] 第②步中Cl2生成Cl-,可知催化剂Cl-的变化历程是Cl-→Cl2→Cl-,即Cl-在第①步中变成Cl2。由题给信息及氧化还原知识可知,氧化剂是ClO,且ClO反应后生成ClO2。离子方程式:2ClO+2Cl-+4H+===2ClO2↑+Cl2↑+2H2O。
[答案] 2ClO+2Cl-+4H+===2ClO2↑+Cl2↑+2H2O
二、催化剂与活化能、焓变
催化剂通过降低反应的活化能而加快反应速率。而且催化剂的性能越好,反应的活化能越低。
[例2] 在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) Ⅰ
CO2(g)+H2(g)⇌CO(g)+H2O(g) Ⅱ
某实验室控制CO2和H2初始投料比为1∶2.2,在相同压强下,经过相同时间测得实验数据如下表所示。在图中分别画出反应Ⅰ在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程—能量”示意图。
【备注】 甲醇选择性:转化的CO2中生成甲醇的百分比。

[解析] 据表中的数据可以算出生成CH3OH的CO2占全部CO2的百分比。543K,Cat.1作用下是12.3%×42.3%≈5.20%,Cat.2作用下是10.9%×72.7%=7.92%。所以Cat.2的催化选择性要好于Cat.1,即在Cat.2的作用下反应的活化能低。
[答案]
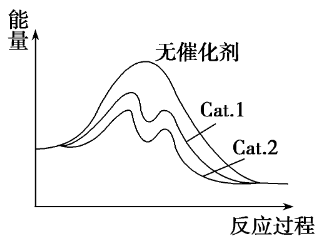
[归纳小结] 作图时还要注意,催化剂不能改变反应物、生成物的总能量,所以曲线的起点、终点应相同。也正是这个原因,所以催化剂不能改变反应的焓变。
三、催化剂与反应速率、平衡移动
催化剂能加快反应速率,缩短到达平衡所需时间。催化剂的活性越好,所需时间越短。但催化剂不能使化学平衡发生移动。
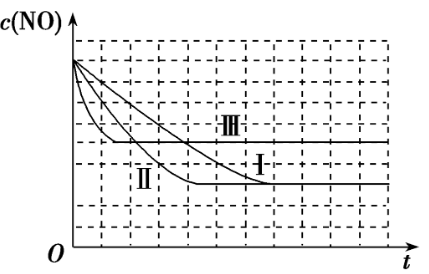
[例3] 密闭容器中发生反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ΔH<0。研究表明:在使用等质量同种催化剂时,增大催化剂比表面积可提高反应速率。某同学设计了下表所示的三组实验。请在图中画出三个实验中c(NO)随时间变化的趋势曲线,并标明实验编号。
[解析] 先比较实验Ⅰ、Ⅱ:实验Ⅱ的催化剂比表面积大,故实验Ⅱ的反应速率大;因催化剂不影响平衡移动,故达到平衡后,实验Ⅰ、Ⅱ的c(NO)相同。再比较Ⅱ、Ⅲ:实验Ⅲ的温度高,故实验Ⅲ的反应速率大;因温度升高,平衡左移,故平衡时c(NO)较大。
[答案]
四、温度与催化剂活性
催化剂具有一定范围的活化温度,过高或过低,都会导致催化剂的活性降低。如生物催化剂酶,对温度就非常敏感。
[例4] (2017·高考天津卷节选)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放……生物脱H2S的原理为
H2S+Fe2(SO4)3===S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4==2Fe2(SO4)3+2H2O
硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是________。若反应温度过高,反应速率下降,其原因是___________。
[解析] 因为硫杆菌能显著加快反应速率,故它是反应的催化剂。当反应温度过高时,硫杆菌会因蛋白质变性而失去了催化性能,反应速率明显下降。
[答案] 催化剂 硫杆菌因蛋白质变性而失去了催化性能。
五、催化剂的来源问题
化学中有一类特殊反应,叫自催化反应,该类反应中的生成物对反应有催化作用。它的特点之一是开始反应速率很小,随着起催化作用的产物的积累速率迅速增大。
[例5] 向三颈烧瓶中加入一定量的MnO2和水,搅拌,通入SO2和N2混合气体,恒温下发生反应:MnO2+H2SO3===MnSO4+H2O。若将N2换成空气,测c(Mn2+)、c(SO42-)随时间T的变化如图所示。导c(Mn2+)、c(SO42-)变化产生明显差异的原因是______________________。
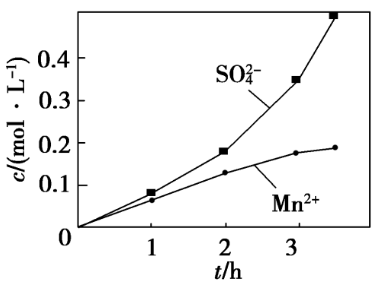
[解析] 由图可知,“N2换成空气”发生了副反应:O2+2H2SO3===2H2SO4。表示c(SO42-)的曲线斜率逐渐增大,说明SO42-的生成速率逐渐增大。因反应物浓度、压强、温度、接触面积等维持不变,所以导致SO的生成速率加快的因素应是催化剂,而且催化剂是某种生成物,应是Mn2+。
[答案]Mn2+对O2和H2SO3的反应有催化作用
[归纳小结]判断一个化学反应是否是自催化反应,先要排除温度、浓度、压强、接触面积等的影响,然后再分析是何种生成物具有催化作用。
六、催化剂、温度对平衡的综合影响
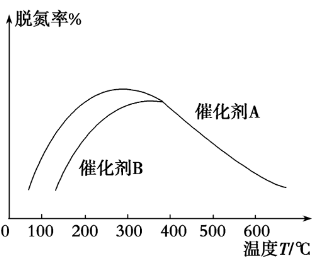
[例6] NH3催化还原氮氧化物技术是目前应用最广泛的烟气脱氮技术:4NH3(g)+6NO(g) ⇌ 5N2(g)+6H2O(g) ΔH<0。密闭容器中,在相同时间内,在催化剂A作用下脱氮率随温度变化如图所示。现改用催化能力稍弱的催化剂B进行实验,请在图中画出在催化剂B作用下的脱氮率随温度变化的曲线(不考虑温度对催化剂活性的影响)。
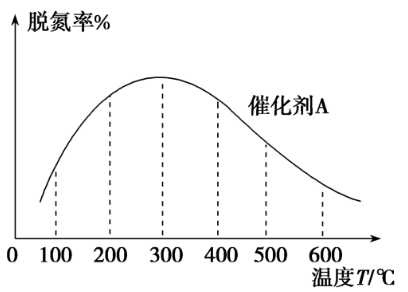
[解析] 先分析催化剂A作用下的脱氮率为什么会先增大后减小。低于300 ℃时,温度越高,反应速率越快,相同时间内消耗的NO越多,所以脱氮率增大。高于300 ℃时,因为温度升高,平衡逆向移动,消耗的NO减小,所以脱氮率下降。
改用催化剂B,就涉及催化剂和温度两个变量,在解题时要分别考虑。①B催化下,随着温度的升高,脱氮率也应先增大后减小。②达到曲线最高点之前,B的催化能力弱,相同温度时的脱氮率要小于A。即所画曲线应在A的下方。③B催化下在相同时间内达到平衡,则曲线最高点应出现在高于300 ℃的位置。④当A、B均达到平衡后,平衡脱氮率只与温度有关,所以两条曲线重合。
[答案]
[概括整合] 催化剂通过参与化学反应,改变反应历程,从而降低活化能,加快反应速率,到达平衡所需的时间减少。但催化剂不能改变焓变,也不能使平衡移动。催化剂的催化性能也会受外界条件的影响,如温度、表面积等。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。...
一、浅谈化学平衡所处的系统 任何可逆反应在一定条件下总会出现平衡状态,因而化学平...
在基于真实情境考查学生综合运用知识的能力的考试理念引导下,与化工生产关系密切的催...
化学反应速率和化学平衡一章内容是中学化学的重要基本理论,因受课本知识的深度和广度...
...
一.水土流失是不可逆的 有这样一个可逆反应: Co(H 2 O) 6 2+ (红色)+4Cl - CoCl 4 2...