
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在各类试题中,经常会涉及到改变一个外 界条件,要我们去分析化学平衡是否移动及结果变化的问题,很多学生都是利用勒沙特列原理来分析,却在运用的过程中总会出现一些问题,甚至得出错误的结论。
题1: 一定温度下,某真空密闭容器投入碳酸钙,发生反应CaCO3 (s) CaO(s) + CO2(g),达到平衡后,现将体积缩小为原来的一半,当体系再次达到化学平衡时的浓度
CaO(s) + CO2(g),达到平衡后,现将体积缩小为原来的一半,当体系再次达到化学平衡时的浓度
A. 增大为原来2倍
B. 比原来大,但比2倍小
C. 不变
D.减小
错解:若平衡不移动,体积缩小为原来的 一半,CO2的浓度增大为原来2倍,但体积减少.压强增大,平衡向逆反应方向移动,选B.
题2:在温度不变,容积固定的密闭容S 中发生如下反应N2O4(g) 2NO2(g),达到平衡后N2O4和NO2均为1 mol,改变下列条 件:(1)向原平衡中再加入1 mol N2O4,平衡如何移动?(2)由原平衡中再各加入1 mol N2O4 和1 mol NO2,平衡如何移动?
2NO2(g),达到平衡后N2O4和NO2均为1 mol,改变下列条 件:(1)向原平衡中再加入1 mol N2O4,平衡如何移动?(2)由原平衡中再各加入1 mol N2O4 和1 mol NO2,平衡如何移动?
错解:(1)容积固定,再加人N2O4,反应物浓度增大,平衡向正反应方向移动;又N2O4 的物质的量增加,增大压强,平衡向气体体积减小的方向移动,即平衡向逆方向移动,所以 无法确定.
(2)再加人N2O4,反应物浓度增大, 平衡向正反应方向移动;又加人NO2,生成物浓度增大,平衡向逆反应方向移动,所以也无法确定.
一、问题的提出
题1和题2均利用勒沙特列原理来解释, 看起来有理有据,其实都是错误的。究其原因 是学生在理解勒沙特列原理时往往会片面地、 错误地理解其原理.在题1和题2中,学生只是机械的运用“压强”对化学平衡的影响,没有深刻理解勒沙特列原理中“压强"的改变是通过容器体积的增加(或减小)来实现的,该操作导 致的直接结果是平衡体系中各物质浓度瞬间均减少(或增加)相同的倍数;换言之,平衡体系中各物质浓度均减少(或增加)相同的倍数, 才可视为压强减少(或增加)对化学平衡影响, 不然就会象上面得出锘误的结论。也正是基于 这一点,学生不知道该考虑浓度还是考虑压强 对平衡影响,怎么办呢?
二、问题的解决一“平衡常数”的高效利用
其实浓度和压强是相互影响,相互制约 的,而压强对化学平衡的影响又能转化为浓度 对化学平衡的影响,利用“平衡常数”恰恰将浓 度和压强有机的统一起来,依托“温度不交,平衡常数也不变”这一原理从定量的角度分析 “浓度”、“压强”对化学平衡影响,将会更直观、 更有说服力。分析如下,供参考。
题1正解平衡常数K=c(CO2),体积缩小为原来的一半,CO2的浓度瞬间增加为原来的2倍,浓度商
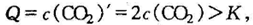
平衡向逆反应方向移动,因“温度不变,平衡常数也不变”,要使Q = K,只c(CO2)'减小到原平衡的浓度,c(CO2)'= c(CO2) ,故选C
题2正解:(1)平衡常数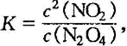 向原平衡加入1 mol N2O4, 瞬间N2O4浓度均增大为原平衡的2 倍,NO2浓度不变,浓度商
向原平衡加入1 mol N2O4, 瞬间N2O4浓度均增大为原平衡的2 倍,NO2浓度不变,浓度商
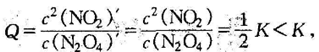
平衡向正反应方向移动,与“浓度对平衡影响结论”一致。
(2)向原平衡加入1 mol N2O4和NO2各1mol,瞬间,N2O4和浓度均增大为原平衡的2 倍,浓度商
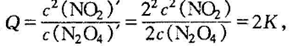
Q>k,平衡向逆反应方向移动,与“平衡体系中各物质浓度均增加相同的倍数,视为增 加压强对化学平衡影咱”结论一致.
题3:在容积可变的密闭容器中进行如下 反应:2SO2(g)+O2(g)  2SO3 (g),反应达到平衡,保持容器内的温度和压强不变,加入少量氦气.平衡如何移动.说明理由.
2SO3 (g),反应达到平衡,保持容器内的温度和压强不变,加入少量氦气.平衡如何移动.说明理由.
解析:平衡常数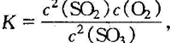 向该平衡体系加入氦气,SO3、SO2和O2的 浓度瞬间均减小相同的倍数,设为原平衡的x 倍(x<1),則浓度商
向该平衡体系加入氦气,SO3、SO2和O2的 浓度瞬间均减小相同的倍数,设为原平衡的x 倍(x<1),則浓度商
Q=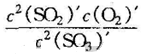 =
=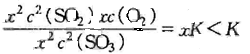
平衡向正反应方向移动.与保持容器内的温度和压强不变,加入惰性气体,体积增大, “平衡体系中各物质浓度均减小相同的倍数, 视为减小压强对化学平衡影响”结论一致.
三、反思
新课标人教版《化学反应股理》中的压 强"对化平衡影响没有像“浓度”和“温度”那样详细地介绍,只是一带而过,这势必给学生增 加了学习难度。当浓度与压强相互影响时,应用勒沙特列原理就有其本身的局限性,此时把压强转化浓度对化学平衡的影响,利用化学平衡常数来理解勒沙特列原理.則能解决学生中的迷惑。因此,在新课标下适时利用“温度不变,平衡常数不变”这一原理定量分析,常有“柳暗花明又一村”的惊喜。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。...
一、公式提出的背景 19世纪末,化学家们逐渐意识到温度对化学反应速率具有显著影响,...
假设对于反应 a A(g) + b B(g) g G(g) + h H(g) 中各物质均为理想气体,那么则有平衡...
例:某温度、起始压强为100 kPa下,若将2mol SO 2 和1molO 2 ,通入恒容密闭容器中,...
...
什么是活化能、能垒? 1 、能垒 活化分子含有的能参加化学反应的最低限度的能量,称为...