
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
绪言
1 P3 一种分子要转变为另一种分子,首先应减弱或破坏分子原子间的化学键
2 P3 右图中:E1 是反应的活化能,E2 是活化分子能量 变成生成物分子付出的能量,能量差 E2-E1 是 反应热
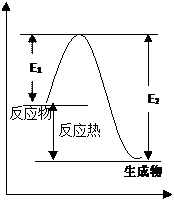
3 P4 活化能的作用在于促进反应物活化,从而启动 反应或改变反应速率
化学反应与能量
1 p1 有些金属氧化物的还原反应(如氢气还原三氧化钨来制取钨)和许多分解反应(如从石灰石制石灰)都是吸热反应
2 P3 被研究的物质系统称为体系,体系以外的其他部分称为环境
3 P4 ΔH 单位中的“每摩尔“既不是指”每摩尔 A“,也不是指”每摩尔 B、C、D”,而是指 每摩尔反应,即 mol-1(aA+ bB== cC+ dD)
4 P7 101KPa 时,1mol 纯物质完全燃烧生成稳定氧化物时所放出的热量叫燃烧热
5 P8 能源是国民经济和社会发展的重要物质基础 ,它的开发利用,可以衡量一个国家或地区的经济发展和科学技术水平
6 P9 几种重要的能源:太阳能、氢能、地热能、风能
7 P12 能量的释放或吸收是以发生变化的物质为基础的,二者密不可分,但以物质为主
8 P15 热化学方程式中,需注明反应的温度和压强。如在 25℃、101KPa 下进行的反 应,可不注明反应的温度和压强
9 P15 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关
化学反应速率与化学平衡
1 P18 测反应速率
①通过释放出气体的体积和体系的压强(如测量锌与硫酸的反应速率,可测生 成一定体积气体所需时间的长短)
②通过科学仪器测量颜色的深浅、光的吸收、光的发射、导电能力等
③在溶液中,当反应物或产物本身有比较明显的颜色时 ,人们常常利用颜色深 浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应速率
2 P20 化学反应速率与分子间的有效碰撞频率有关
3 P20 2KMnO4 + 5H2C2O4 + 3H2SO4 == K2SO4 +2MnSO4 + 10CO2 + 8H2O
2KMnO4 + 6HCl =2MnCl2+ 5Cl2 + 8H2O + 2KCl
4 P20 反应物浓度增大,活化分子数也增多,有效碰撞的几率增加,反应速率也就增大了
5 P21 Na2S2O3 + H2SO4 == Na2SO4 + SO2 + S +H2O
6 P21 温度升高的主要作用归纳为两个方面:
①通过提高温度使分子获得更高的能量活化分子百分数提高;
②含有较高能量的分子间的碰撞频率也提高。
7 P21 4H+ +4I- +O2== 2I2+2H2O ;5I- + 6H+ +IO3-== 3I2+3H2O
8 P22 降低活化能可以降低反应所需的温度,还有利于减少过程中的能耗
9 P22 催化剂能加快反应速率,是因为它能改变反应的路径,使反应所需的活化能 降低
10 P23 对于给定条件下反应物之间能够同时发生多个反应的情况,理想的催化剂还 可以大幅度提高目标产物在最终产物中的比率,催化剂的这种特性称作它的 选择性
11 P23 在试管中加入淀粉溶液和碘水,再加入 H2SO4 溶液,加热时颜色会变浅,冷 却后会恢复原来的颜色
12 P24 影响化学反应速率的外界条件除浓度、压强、温度、催化剂外,还有很多因 素可以影响反应速率,如:光辐射、放射线辐照、超声波、电弧、强磁场 、 高速研磨等
13 P24 催化剂中毒:催化剂活性降低,催化效果不明显
14 P24 2CO + 2NO== N2 + 2CO2 将汽车尾气中的 NO 和 CO 等有毒气体反应转 化为无污染的气体,可加催化剂加快反应速率
15 P25 (溶解结晶过程),当溶解速率与结晶速率相等时,即饱和溶液,达到溶解平衡状态
16 P26 CrO42-(橙色) + H2O 2Cr2O72-(黄色) + 2H+
2Cr2O72-(黄色) + 2H+
17 P28 Fe(SCN)3 是红色物质,不是沉淀,不能用沉淀符号
18 P28 催化剂能同等程度地增加正反应速率与逆反应速率,因此不影响化学平衡
19 P31 1884 年,勒夏特列根据大量事实提出了勒夏特列原理
20 P32 PCl3(g) + Cl2(g)  PCl5(g)
PCl5(g)
21 P33 CO(g) + H2O(g)  CO2(g) + H2(g)
CO2(g) + H2(g)
22 P34 不用借助外力就可以自动进行的自发过程的共同特点:从高能状态变为低能 状态
23 P35 过程的自发只能用于判断过程的方向,不能判断过程是否一定会发生和过程 的发生速率,例:涂有防锈漆和未涂防锈漆的刚性器件,其发生腐蚀过程的 自发性是相同的,但只有后者可以实现
24 P35 熵 S(g) > S(l) > S(s)
25 平衡常数是有单位的,并随平衡常数表达式的不同而不同,在书写的时候要写上 单位
26 化学平衡发生移动的标志
水溶液中离子平衡
1 P39 离子反应的速率决定于溶液中离子的浓度和离子的扩散速率,受温度影响不 大,是一类不需要用活化能引发的反应
2 P39 利用离子反应可制造纳米材料
3 P40 盐酸常用于卫生洁具的清洁或去除水垢
4 P41 弱电解质电离成离子的速率随溶液里弱电解质的浓度逐渐减小而减小,同时 因离子浓度逐渐增大,结合成分子的速率则不断增大,最终两者速率相等 ,达到电离平衡状态
5 P43 分子中含有两个或两个以上可电离 H+的多元弱酸是分步进行的
6 P43 H2S  H++ HS- HS-
H++ HS- HS- H+ +S2-
H+ +S2-
7 P43 对于分步电离的物质,电离常数 K1 >> K2 >> K3
8 P43HIn(红色) H+ + In-(黄色)
H+ + In-(黄色)
9 P45 pH 试纸是将试纸用多种酸碱指示剂的混合溶液浸透,经晾干制成的
10 P45 pH 试纸有广泛 pH 试纸和精密 pH 试纸。广泛 pH 试纸的 pH 范围是 1-14 或 0-10,可以识别的 pH 差值为 1;精密 pH 试纸的 pH 范围较窄,可以判别 0.2或 0.3 的 pH 差值
11 P45 人体各种体液都有一定的 pH,以保证正常的生理活动
12 P45 护发素的主要功能是调节头发的 pH 使之达到适宜的酸碱度
13 P48 进行酸碱滴定时,当接近滴定终点时,很少量(0.04mL 约一滴)的酸或碱就会引起溶液 pH 的突变
14 P49 变色范围:甲基橙 3.1-4.4 石蕊 5.0-8.0 酚酞 8.2-10.0 酸碱滴定时,一般不选择石蕊做指示剂
15 p51 进行酸碱滴定时,如果滴定管内部有气泡,应快速放液以赶走气泡
16 P54 C5H8NO4Na (谷氨酸钠、味精)
17 P54 碳酸钠溶液呈碱性,具有较强的去污能力
18 P57 生成盐的弱酸(碱)越弱,即越难电离,该盐的水解程度越大
19 P57 水解反应的逆反应是中和反应
20 P57 在配制氯化铁溶液时,为了抑制水解可加入少量盐酸,以防止溶液浑浊
21 P58 TiCl4+ (x+2) H2O(过量) ==TiO2· xH2O + 4HCl 利用此方法可制备 TiO2,类似的方法也可用来制备 SnO、SnO2、Sn2O3
22 P58 Kw:水的离子积常数 Kb:弱碱电离常数Ka:弱酸电离常数 Kh:盐的水解常数KW
①对于强碱弱酸盐有
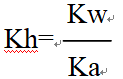
②对于强酸弱碱盐有
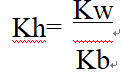
23 P58 弱酸弱碱盐溶液根据其组成不同,可能呈中性、酸性或碱性
24 P59 盐碱地是指土地中含有较多的 NaCl、Na2CO3
25 P59 SOCl2 是一种液态化合物,沸点为 77℃ SOCl2 + H2O== SO2 + 2HCl
26 P60 2SbCl3 + 3H2O ==Sb2O3 + 6HCl MgCl2 · 6H2O ==Mg(OH)Cl + HCl + 5H2O
27 p60 MgSO4 · 7H2O 受热不易发生水解
28 p62通常认为残留在溶液中的离子浓度小于 1×10-5mol/L 时,沉淀就达完全
29 p64水垢中含有硫酸钙,可先用碳酸钠溶液处理,使之转化为疏松易溶于酸的碳酸钙,而后用酸去除
30 p65沉淀转化的实质就是沉淀溶解平衡的移动
31 p65离子积 Qc 和 Ksp 的比较,确定沉淀的溶解、形成和平衡状态
32 p66羟基磷灰石转化为氟磷灰石,氟化物可用于防治龋齿
电化学基础
1 P71 锌铜原电池装置图
盐桥:装有含琼脂的 KCl 饱和溶液。电池工作时,K+移向正极,Cl-移向负极
2 P73 红热的铁丝与冷水接触,表面形成蓝黑色保护层,蓝黑色保护层为 Fe3O4
3 P75 碱性锌锰电池:Zn + 2MnO2+2H2O == 2MnOOH + Zn(OH)2
负极:Zn - 2e- + OH- == Zn(OH)2
正极:2MnO2+2H O + 2e-==2MnOOH + 2OH-
4 P75 锌银电池(电解质为碱):Zn + Ag2O + H2O==Zn(OH)2+2Ag
负极:Zn - 2e- + OH-= Zn(OH)2
正极:Ag O + H2O+ 2e- == 2Ag +2OH-
5 P75 锂电池:负极材料:Li 正极材料:MnO2、CuO、FeS2
6 P76 铅蓄电池:Pb(s) + PbO2(s) + 2H2SO4(aq)  2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)
7 P77 燃料电池(注意酸性、碱性条件下的电极反应 )(以甲醇燃料电池为例)
8 P78 镉镍电池:Cd + 2NiO(OH) +2H2O == Cd(OH)2 + 2Ni(OH)2
9 P81 电解应用:
①氯碱工业:2NaCl + 2H2O  2NaOH + H2 +Cl2
2NaOH + H2 +Cl2
②电镀:镀件做阴极,镀层金属做阳极,含镀层金属离子的电解质溶液
③铜的电解精炼:阳极泥通常为金、银、铂等
④电冶金:活泼金属的冶炼(如:钠、钙、镁、铝)
10 P85 铁的两种电化学腐蚀
11 P86 金属的电化学防护:
①牺牲阳极的阴极保护法:船身装锌块
②外加电流的阴极保护法:被保护金属作阴极
12 P87 Fe2+的检验方法:3Fe2++ 2[Fe(CN)6 ]3- == Fe3 [Fe(CN)6 ](蓝色,铁氰化亚铁沉淀)

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。在笔者的教学工作中,常常能听到一部分学生反馈自己基础比较差,或者前期未认真学习后...
一、氧化还原反应 (一)回扣要点知识 (二)辨析易混易错问题 判断下列说法是否正确...
1、 掌握一图(原子结构示意图)、五式(分子式、结构式、结构简式、电子式、简式)、六方...
1. 熔化状态下能导电的物质一定是电解质。 不一定,如金属单质(Cu) 2. 熔化状态下不能...
一、原子结构与性质 (1)原子均由质子数、中子数和核外电子组成; 错因分析:特例: 1 ...
高中化学教材中,有一个平衡理论体系,包括 溶解平衡、化学平衡、电离平衡、水解平衡...