
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
常见化学电源有以下几种,一次电池包括锌锰电池、碱性锌锰电池、锌银电池;充电电池包括铅蓄电池、镍镉电池;燃料电池包括氢氧燃料电池、甲烷电池。
一、一次电池
1.普通干电池,最常见的电池。负极材料Zn,正极材料MnO2,电解质NH4Cl。
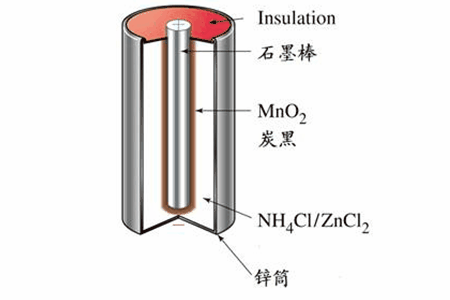
反应原理
Zn+2MnO2+2NH4Cl=Mn2O3+ZnCl2+2NH3↑+H2O
负极(Zn):Zn-2e-=Zn2+
正极(MnO2和C):2MnO2+2NH4++2e-=Mn2O3+2NH3↑+H2O
表示方法:(-)Zn│NH4Cl+ZnCl2│MnO2,C(+)
2.碱性锌锰电池,为了延长电池寿命,提高性能,将普通锌锰电池中电解质氯化铵换为氢氧化钾,负极材料Zn,正极材料MnO2,电解质KOH。
反应原理
Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2
负极(Zn):Zn+2OH--2e-=Zn(OH)2
正极(MnO2):2MnO2+2H2O+2e-=2MnO(OH)+2OH-
表示方法:(-)Zn│KOH│MnO2(+)
3.锌银电池(纽扣电池),电池体积下,比能量大、电压稳定,储存时间长。负极材料Zn,正极材料Ag2O,电解质KOH。
反应原理
Zn+Ag2O+H2O=Zn(OH)2+2Ag
负极(Zn):Zn+2OH--2e-=Zn(OH)2
正极(Ag2O):Ag2O+H2O+2e-=2Ag+2OH-
表示方法:(-)Zn│KOH│Ag2O(+)
二、充电电池(二次电池)
二次电池在放电时是原电池,遵循原电池工作原理;在充电时是电解池,遵循电解原理;给二次电池充电充电时,外加电源的负极连接电池的负极。
1、铅蓄电池,最常见的二次电池,负极板材料Pb,正极板材料PbO2,电解质材料H2SO4。
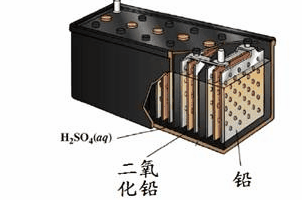
电池总反应:Pb+PbO2+2H2SO4 2PbSO4+2H2O
2PbSO4+2H2O
①放电反应:
负极(Pb):Pb-2e-+SO42-=PbSO4
正极(PbO2):PbO2+2e-+4H++SO42-=PbSO4+2H2O
②充电反应:
阴极(接电源负极发生还原反应):PbSO4+2e-=Pb+SO42-
阳极(接电源正极发生氧化反应):2PbSO4+2H2O-2e-=PbO2+4H++SO42-
表示方法:(-)Pb│H2SO4│PbO2(+)
铅蓄电池可重复使用、电压稳定、使用方便、安全可靠、价格低廉。但比能量低、笨重、废弃电池污染环境等。其它二次电池:镍镉电池、镍氢电池、锂离子电池、聚合物锂离子蓄电池等一系列新型蓄电池已逐渐占领二次电池的市场。
2、镍镉电池,体积较小,寿命更长。负极材料Cd,正极材料NiO(OH),电解质KOH。
电池总反应:Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
①放电反应:
负极(Cd): Cd+2OH-→Cd(OH)2+2e-
正极(NiO(OH)):2NiO(OH)+2e-+2H2O→2Ni(OH)2+2OH-
总反应: Cd+2NiO(OH)+2H2O=2Ni(OH)2+Cd(OH)2
②充电反应:
阳极(Ni(OH)2):2Ni(OH)2+2OH--2e-→2NiO(OH)+2H2O
阴极(Cd(OH)2):Cd(OH)2+2e-→ Cd+2OH-
表示方法:(-)Cd│KOH│NiO(OH)(+)
三、燃料电池
燃料电池是以还原剂(氢气、烃类、甲醇等)为负极反应物,以氧化剂(氧气、空气)为正极反应物,将燃料和氧化剂的化学能直接转化成电能的化学电池。
1.氢氧燃料电池,负极氢气为还原剂,正极氧气为氧化剂,铂做电极。
反应原理:2H2+O2=2H2O
①以酸性溶液为电解液构成的氢氧燃料电池:
负极(Pt):2H2-4e-=4H+;
正极(Pt):O2+4H++4e-=2H2O
电池的表示方法:(-)Pt│H2│H+│O2│Pt(+)
②以碱性溶液为电解液构成的氢氧燃料电池:
负极(Pt):2H2-4e-+4OH-=4H2O;
正极(Pt):O2+2H2O+4e-=4OH-.
电池的表示方法:(-)Pt│H2│OH-│O2│Pt(+)
2.甲烷燃料电池,负极甲烷为还原剂,正极氧气为氧化剂,。以碱性(KOH)溶液为电解质溶液。
反应原理:CH4+2O2+2KOH=K2CO3+3H2O
负极(Pt):CH4+10OH--8e-=CO32-+7H2O
正极(Pt):2O2+4H2O+4e-=8OH-
电池的表示方法:(-)Pt│CH4│KOH│O2│Pt(+)
燃料电池的特点是:氧化剂与还原剂在工作时不断补充;反应产物不断排出;优点是:能量转化率高、清洁、对环境好,有利于节约能源。缺点:体积较大、附属设备较多。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。化学能是内能中与化学键相关的一部分;而焓是一个包含内能,并考虑到在常压环境下做功...
加热一般是指使用酒精灯提供的热量使反应持续进行; 高温是指所需温度超过了酒精灯能...
先说说放热反应和吸热反应。有同学错误地认为: “ 吸热反应是吸收了热量,所以反应体...
先说说放热反应和吸热反应。有同学错误地认为: “ 吸热反应是吸收了热量,所以反应体...
化学平衡理论是中学化学最重要的基础理论之一,是研究可逆反应、弱电解质电离、盐类水...
1 . KClO 3 分解制 O 2 ,为什么加入一些 MnO 2 ? 因为 MnO 2 对 KClO 3 的分解有催...