
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
银及其化合物的一些知识是中学化学元素化合物内容的有机组成部分,但在教材中这部分内容散而乱,为此笔者从性质和用途等方面对这部分知识简单概括。
一、单质
单质银是银白色金属,密度10.5g/cm3,熔点962℃,硬度2.5-4,延展性仅次于金,导电传热性在所有金属中最好。
在金属活动顺序表中,银位于氢之后,化学性质很不活泼,它不能置换出稀酸中的氢,但能与浓稀硝酸、热的浓硫酸和三氯化铁等作用
Ag+2HNO3(浓)=AgNO3+NO2↑+H2O
3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O
2Ag+2H2SO4(浓) Ag2SO4+SO2↑+2H2O
Ag2SO4+SO2↑+2H2O
FeCl3+Ag===AgCl↓+FeCl2
即使在加热情况下,银也很难与水、空气中的氧化合,但能与卤素、硫作用
2Ag+Cl2==2AgCl 2Ag+S==Ag2S
另外空气中如含有H2S气体,跟银接触后,在其表面能生成一层Ag2S的黑色薄膜
4Ag+O2+2H2S=== 2Ag2S+2H2O
在臭氧中,能发生:2Ag+2O3===Ag2O2+2O2
银元素在地壳中主要以游离态和硫化物形式存在,由于其含量较低,一般采用氰化法提炼,反应如下:
4Ag+8NaCN+2H2O+O2===4Na[Ag(CN)2]+4NaOH
Ag2S+4NaCN===2Na[Ag(CN)2]+Na2S
然后用锌或铝还原,使银从溶液中析出:
2Na[Ag(CN)2]+Zn===Na2[Zn(CN)4]-+2Ag
另外还可以从电解精炼铜的阳极泥中得到银。
在所有的金属中,银反光性是无与伦比的,在抛光以后几乎可以100%地反光,因此是制作镜子的最好材料;银在所有金属中导电导热性最好,因而在许多电器特别是在导体、开关接触器和熔断器中应用较多;在照相业、首饰、银器、银币等也用大量的银;在有机化学中,还可作为催化剂广泛应用,例如: 乙醇在单质Ag或Cu催化下,可被氧化成乙醛,其催化原理为:
4Ag+O2 2Ag2O C2H5OH+Ag2O
2Ag2O C2H5OH+Ag2O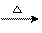 CH3CHo+2Ag+H2O:
CH3CHo+2Ag+H2O:
二、银的氧化物和氢氧化物
在AgNO3溶液中加入碱溶液,首先析出白色沉淀AgOH,AgOH在常温下立即脱水生成暗棕色的Ag2O。但如果用溶于90%酒精溶液的硝酸银和氢氧化钾,在低于-45℃下,小心进行沉淀,可得到白色的AgOH。Ag2O密度7.143g/cm3加热到100℃即开始分解,到300℃时完全分解为氧气和银。
2Ag2O 4Ag+O2
4Ag+O2
Ag2O微溶于水,极易溶于NH3·H2O、HNO3、Na2S2O3等
Ag2O+4NH3·H2O===[Ag(NH3)2]OH+4H2O
Ag2O+2HNO3===2AgNO3+H2O
Ag2O氧化性强,容易被CO或H2O2还原:
Ag2O+CO2===2Ag+CO2
Ag2O+H2O2===2Ag+H2O+O2↑
利用上述原理可将Ag2O用于防毒面具中。
在钮扣式电池中,常见的银锌电池:电极反应为
负极:Zn+2OH--2e-===ZnO+H2O
正极:Ag2O+H2O+2e-===2Ag+2OH-
电池总反应式:Ag2O+Zn===2Ag+ZnO
三、银盐
1、 AgNO3
将Ag和HNO3作用可制得AgNO3。
AgNO3是无色晶体,易溶于水,熔点208.5℃,加热到440℃时分解,如有微量的有机物存在或受日光照射也会发生分解,2AgNO3 2Ag+2NO2+O2,所以,它的晶体和溶液应保存在棕色试剂瓶中,
2Ag+2NO2+O2,所以,它的晶体和溶液应保存在棕色试剂瓶中,
AgNO3是一种氧化剂,例如可将Fe2+氧化为Fe3+:
Ag++Fe2+== Fe3++Ag
也能与许多有机物发生氧化还原反应。例如在实验室使用AgNO3溶液时,不小心沾在皮肤上就会发现皮肤变黑,其原因是AgNO3遇到蛋白质生成了黑色的蛋白银。用AgNO3在衣服上做标记就是由于它能被纺织品还原得到黑色的银。
大量的硝酸银用于制造照相底片上的卤化银。AgNO3还是重要的分析试剂,在实验室常用它来检验Cl-、Br-、I-、PO43-等的存在。因AgNO3对有机组织有破坏作用,因此在医药上可用作消毒剂和腐蚀剂。AgNO3也是制备其它Ag(Ⅰ)盐的原料
2、卤化银
用相应可溶性卤化物与硝酸银作用,可以制得AgCl、AgBr、AgI。而AgF易溶于水,故常用Ag2O与氢氟酸HF作用而制得:Ag2O+2HF===2AgF+H2O。AgF、AgCl、AgBr和AgI固体的颜色逐渐加深,AgF易溶于水,其余均难溶于水和HNO3。 AgCl能溶于氨水、Na2S2O3和KCN溶液;AgBr难溶于氨水但易溶于Na2S2O3和KCN溶液;AgI难溶于氨水和Na2S2O3溶液但易溶于KCN溶液
常见难溶银盐的溶解度大小为:SAgCl>SAgBr>SAgI>SAg2S,依次加入Br-、I-、S2-可实现沉淀转化:AgCl→AgBr→AgI→Ag2S。Ag2S不溶于盐酸、硫酸和稀硝酸,但溶于浓硝酸。
AgCl、AgBr、AgI都有感光性,见光分解为银,故广泛用于摄影术中。AgBr感光最快,是照相底片、放大纸的主要感光剂,AgCl感光较慢,常用以制作印象纸;AgI感光最慢,很少单独使用,但在AgBr或AgCl的乳剂中加少量AgI,可以改善感光性能。在照相底片、印相纸上有一层很薄很薄的散布有细小的溴化银的明胶,溴化银在光线的作用下2AgBr 2Ag+Br2后,银以微小到普通显微镜下都看不见的晶粒析出,溴与明胶化合,将感光后的底片于暗室中用有机还原剂对苯二酚等将含有银核的AgBr进一步还原为银,即显影
2Ag+Br2后,银以微小到普通显微镜下都看不见的晶粒析出,溴与明胶化合,将感光后的底片于暗室中用有机还原剂对苯二酚等将含有银核的AgBr进一步还原为银,即显影
HO—— ——OH ===- O——
——OH ===- O——  ——O-+2H+
——O-+2H+
-O—— ——O-+2Ag+=== O===
——O-+2Ag+=== O===  === O +2Ag
=== O +2Ag
经过一定时间显影后,再把底片浸入Na2S2O3溶液中去除未感光的AgBr,即定影过程,
AgBr+2S2O32-=Ag(S2O3)23-+Br-这样就得到了照相底片,然后,再将底片和在照相纸上再经感光、显影和定影等过程就成了相片。
AgI可用于人工降雨。天空中有云而不下雨,其主要原因是云层中小冰晶数目太少,因为AgI与小冰晶极相似,当用小火箭,高射炮等工具把研成细粉末状的AgI发射到几千米的高空时,AgI就以假乱真代替真冰晶体,不用多时就会引起空气里的水蒸气凝结成雨,这就是AgI可用于人工降雨的原因。
3、 Ag2CO3
Na2CO3与AgNO3反应可得到Ag2CO3,Ag2CO3为淡黄色粉末,密度为6.77g/cm3,218℃分解成Ag2O和CO2,难溶于水易溶于硝酸、 氨水、Na2S2O3等溶液。实验室检验卤素时,CO32-等离子有干扰,则可利用卤化银难溶于硝酸,而Ag2CO3易溶于硝酸且产生气体的性质使上述银盐区别开来。
4、 配合物
银的配合物广泛用于制镜、电镀工业和照相技术等方面。例如在AgNO3溶液中,逐滴加入稀氨水,直到最初产生的沉淀恰好溶解为止,在此反应过程中,首先生成白色沉淀AgOH,AgOH极不稳定,立即脱水生成暗棕色的Ag2O沉淀,AgOH及Ag2O均能溶于氨水形成银氨溶液。银氨溶液中的[Ag(NH3)2]+配离子能均匀地释放出Ag+而被含醛基的物质还原生成银即发生银镜反应:如CH3CHO+2Ag(NH3)2++2OH-→CH3COO-+3NH3+NH4++2Ag+H2O,银镜反应用于鉴定醛(R—CHO)及制镜和保温瓶。
银氨溶液必须随配随用,不可久置,否则会生成极易爆炸的物质Ag3N,而产生危险。因此用毕后必须及时加盐酸破坏掉溶液中的[Ag(NH3)2]+使之转化为氯化银回收
电镀工业中用[Ag(CN)2]-配合物镀银,可使镀层光洁致密。但镀液剧毒,因此近年来国内外对无氰电镀研究较多。例如目前常用的一种无氰镀液是[Ag(SCN)2]-和KSCN(混合液)。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。元素种类 对应物质的常考易错点 N 性质:(1)浓HNO 3 和Cu(足量)在反应时,随反应进行...
例题1:浓硫酸与金属反应的条件 题目:常温下,浓硫酸能否与金属铁发生反应? 错误答...
鲍林在研究含氧酸时,将其化学式一般写作 HRO,其中 R 代表中心原子,羟基(–OH)与...
...
一、银47Ag 银亲硫,极化能力强。在自然界中常以自然银、硫化物等形式存在,因其离子...
一、镓Ga 从铝土矿Al 2 O 3 或闪锌矿Zns的冶炼过程中提取,最后经电解制得纯净镓。 门...