
|
学习小专题 |
 如何计算多元弱酸溶液中的粒子浓度大小?
日期:2022-01-03 11:05:46
点击:1338
好评:0
如何计算多元弱酸溶液中的粒子浓度大小?
日期:2022-01-03 11:05:46
点击:1338
好评:0
多元弱酸在水中是分步电离的,因此,计算时应考虑电离 / 反应程度。 向 0.10mol/L 草酸溶液中加 NaOH固体 溶液至 pH=6, 试求溶液中 H 2 C 2 O 4 、 HC 2 O 4 - 和 C 2 O 4 2- 的浓度。 已知: H 2 C 2 O 4 的 K 1 =5.4*10 -2 、 K 2 =5.4*10 -5 题目中尽管使用 K, 经验...
 离子浓度大小比较题型归类解析
日期:2020-07-31 08:20:57
点击:24648
好评:0
离子浓度大小比较题型归类解析
日期:2020-07-31 08:20:57
点击:24648
好评:0
离子浓度大小比较是近几年高考的热点之一,纵观全国和地方高考试题几乎出现率100%,由于决定离子浓度大小的因素很多,诸如物质的量,溶解度,电离程度,水解,化学反应等。另外,要正确快速解决该类题还应具备熟练掌握各种平衡知识如溶解平衡、电离平衡、水解平衡、电荷...
 从九个方面关注离子浓度大小比较问题
日期:2020-02-22 12:04:40
点击:26798
好评:0
从九个方面关注离子浓度大小比较问题
日期:2020-02-22 12:04:40
点击:26798
好评:0
电解质溶液中离子浓度大小比较问题,是高考的 热点 之一。 高考化学试卷年年涉及这种题型。这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、电离度、水的电离、 pH 值、离子反应、盐类水解等基本概念的掌握...
 微课视频:溶液中粒子浓度大小比较与定量关系
日期:2017-10-23 16:48:32
点击:414
好评:0
微课视频:溶液中粒子浓度大小比较与定量关系
日期:2017-10-23 16:48:32
点击:414
好评:0
微课视频:溶液中粒子浓度大小比较与定量关系。...
 碳酸氢钠溶液中微粒浓度关系
日期:2016-02-02 21:32:31
点击:13322
好评:0
碳酸氢钠溶液中微粒浓度关系
日期:2016-02-02 21:32:31
点击:13322
好评:0
碳酸氢钠溶于水后,存在下列电离过程和水解过程: NaHCO 3 =Na + +HCO 3 - HCO 3 - H + +CO 3 2- H 2 O H + +OH - HCO 3 - +H 2 O H 2 CO 3 +OH - 在碳酸氢钠溶液中,存在两种分子和五种离子。 一、 大小关系...
 离子浓度大小比较高考题型解析
日期:2016-01-07 20:44:58
点击:13451
好评:0
离子浓度大小比较高考题型解析
日期:2016-01-07 20:44:58
点击:13451
好评:0
一.离子浓度大小比较的一般思路: 1、从盐类的水解的特征分析:水解程度是微弱的(一般不超过 2)。例如:NaHCO 3 溶液中, c (HCO 3 - )>> c (H 2 CO 3 )或 c (OH - ) 2、理清溶液中的平衡关系并分清主次: 3、灵活运用三种守恒关系:电荷守恒、物料守恒及质子守恒...
 电解质溶液中粒子浓度大小比较专题
日期:2016-01-07 20:42:30
点击:34204
好评:0
电解质溶液中粒子浓度大小比较专题
日期:2016-01-07 20:42:30
点击:34204
好评:0
电解质溶液中粒子浓度大小比较历来是高考中考查化学基本理论知识方面的重点和热点题型。这类试题考查的知识点多,灵活性、综合性强,有较好的区分度,能有效地测试出考生对弱电解质的电离平衡、盐类水解、电解质之间的反应等基本概念、基本理论的掌握情况及对这些知识...
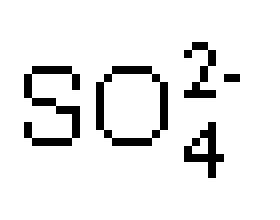 离子浓度大小的比较专题
日期:2016-01-07 20:41:54
点击:23332
好评:0
离子浓度大小的比较专题
日期:2016-01-07 20:41:54
点击:23332
好评:0
一、离子浓度大小的比较 这类问题包括一种物质的溶液和两种物质的溶液。具体分析问题和解题是要先整体,后局部;先宏观,后微观。对于一种电解质溶液,先观看,后分析;对于两种电解质混合的溶液,由于反应,则应先计算,后观看。具体解题思路是:算相关的物质的量,看...
 碳酸氢钠溶液中离子浓度大小的比较
日期:2012-01-12 09:37:22
点击:20822
好评:0
碳酸氢钠溶液中离子浓度大小的比较
日期:2012-01-12 09:37:22
点击:20822
好评:0
碳酸氢钠溶液中离子浓度大小的比较问题存在着较大的分歧,最关键的问题是[OH - ]、[H + ]和[CO 3 2- ]的大小比较。 观点为1:在碳酸氢钠溶液中每电离1mol HCO 3 - ,便产生1mol CO 3 2- 和1mol H + ,在这个基础上再考虑水的电离,而每1mol水的电离便产生1mol H + 和1mol OH...
 盐溶液中离子浓度关系分析的常见切入点
日期:2008-07-11 04:11:29
点击:6657
好评:0
盐溶液中离子浓度关系分析的常见切入点
日期:2008-07-11 04:11:29
点击:6657
好评:0
除醋酸铅、氯化亚汞等少数盐是弱电解质外,大多数盐是强电解质,在溶液中能完全电离,不存在溶质分子,但盐的离子可能会发生水解反应,盐的水解反应一般是可逆的,存在水解平衡,其中弱酸的酸式酸根离子还存在电离平衡,溶液中,溶剂水也存在电离平衡。 首先必须明确溶...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。