
|
学习小专题 |

|
学习小专题 |
 [元素化合物] 金属与酸的反应规律解读 作者:化学自习室 来源:未知 日期:2021-08-17 15:28:31 点击:1325 所属专题:金属与酸
[元素化合物] 金属与酸的反应规律解读 作者:化学自习室 来源:未知 日期:2021-08-17 15:28:31 点击:1325 所属专题:金属与酸
根据金属活动顺序表K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au可从定性和定量两方面进行归纳总结: 一、定性方面 ①排在金属活动性顺序表H前面的金属,和非氧化性酸(如盐酸、稀硫酸等)反应时得到的是H 2 。例如 Zn+H 2 SO 4 ===ZnsO 4 +H 2 ↑。 ②排在...
 [元素化合物] 酸式盐相关性质总结 作者:化学自习室 来源:未知 日期:2021-05-21 10:49:28 点击:3651 所属专题:酸式盐
[元素化合物] 酸式盐相关性质总结 作者:化学自习室 来源:未知 日期:2021-05-21 10:49:28 点击:3651 所属专题:酸式盐
在离子反应这一部分,高中化学与初中化学最大的区别莫过于酸式盐的大量出现。酸式盐的性质多样,反应时关系复杂,是化学推断题中非常青睐的考点。下面便对酸式盐做一个简要的总结。 I. 基本概念 酸式盐是弱酸中的氢离子部分被碱中和的产物,其中含有酸式酸根离子。酸式盐在...
 [元素化合物] 常考易错的物质的性质与用途举例 作者:化学自习室 来源:未知 日期:2022-12-12 15:32:28 点击:787 所属专题:物质性质与用途
[元素化合物] 常考易错的物质的性质与用途举例 作者:化学自习室 来源:未知 日期:2022-12-12 15:32:28 点击:787 所属专题:物质性质与用途
1.物质的性质、用途均正确、存在逻辑关系 物质的性质与用途 解释 (1)Na 2 O 2 与H 2 O、CO 2 能反应,可用作呼吸面具的供氧剂 Na 2 O 2 与H 2 O、CO 2 反应产生O 2 ,可作供氧剂 (2)NaHCO 3 具有弱碱性,可用于制胃酸中和剂 胃酸的主要成分是HCl,NaHCO 3 具有弱碱性,...
 [元素化合物] 分类例析化学反应中的“先后”顺序 作者:化学自习室 来源:未知 日期:2022-08-11 16:14:15 点击:1349 所属专题:反应先后 化学反应
[元素化合物] 分类例析化学反应中的“先后”顺序 作者:化学自习室 来源:未知 日期:2022-08-11 16:14:15 点击:1349 所属专题:反应先后 化学反应
第一类、放出气体或生成沉淀时的反应先后: 1、向Na 2 CO 3 和NaOH的混合溶液中滴入稀HCl。 稀HCl能与Na 2 CO 3 反应生成CO 2 气体,也能与NaOH发生中和反应,但实际反应时,NaOH先和HCl中和,等NaOH被反应完后,Na 2 CO 3 才能和HCl反应放出CO 2 气体。因为CO 2 会被Na...
 [元素化合物] 高中化学溶液互滴方程式最全总结 作者:化学自习室 来源:未知 日期:2022-08-04 15:26:42 点击:1141 所属专题:互滴
[元素化合物] 高中化学溶液互滴方程式最全总结 作者:化学自习室 来源:未知 日期:2022-08-04 15:26:42 点击:1141 所属专题:互滴
一、NaOH 1、向AlCl 3 溶液中滴入NaOH溶液至过量,先出现白色沉淀,后沉淀消失。其离子反应分步写: (1)Al 3+ +3OH - ==Al(OH) 3 ↓ (2)Al(OH) 3 +OH - ==Al O 2 - +2H 2 O 若向NaOH溶液中滴入AlCl 3 溶液至过量,边滴边振荡,开始时无明显现象,后出现白色沉淀...
 [元素化合物] 物质的性质和用途总结 作者:化学自习室 来源:未知 日期:2022-12-12 15:32:47 点击:2557 所属专题:物质性质和用途
[元素化合物] 物质的性质和用途总结 作者:化学自习室 来源:未知 日期:2022-12-12 15:32:47 点击:2557 所属专题:物质性质和用途
一、常见无机物性质和用途 1、氢元素(H) (1)H 2 :探空气球,氢氧焰,冶金,合成氨,高能无害燃料,燃料电池 (2) 2 1 H和 3 1 H用于制造氢弹 2、稀有气体 (1)稀有气体:保护气,霓虹灯、激光 3、碳元素(C) (1)金刚石:金刚石是自然界中最硬的物质,制钻头 (2)活性炭:去...
 [元素化合物] 高考化学违反规律的“特例”大搜集 作者:化学自习室 来源:未知 日期:2021-03-23 15:30:26 点击:705 所属专题:一般与特殊
[元素化合物] 高考化学违反规律的“特例”大搜集 作者:化学自习室 来源:未知 日期:2021-03-23 15:30:26 点击:705 所属专题:一般与特殊
1.原子都是由质子、中子和电子组成,但氢的同位素氕却无中子。 2.同周期的元素中,原子最外层电子越少,越容易失去电子,还原性越强,但Cu、Ag原子的还原性却很弱。 3.原子电子层数多的其半径大于电子层数少的,但锂的原子半径大于铝的原子半径。 4.主族元素的最高正价一般...
 [元素化合物] 化学方程式配平方法总结 作者:化学自习室 来源:未知 日期:2021-03-23 14:59:30 点击:2540 所属专题:化学方程式配平
[元素化合物] 化学方程式配平方法总结 作者:化学自习室 来源:未知 日期:2021-03-23 14:59:30 点击:2540 所属专题:化学方程式配平
在化学反应的过程中,遵守能量守恒定律。为了使方程式满足质量守恒定律,就需要对其进行配平。 在化学学习中,方程式配平是高考必考的一项内容,然而,你不会~不会~不会!那就快来看看学霸们都是怎么做的吧! (一)最小公倍数法 这种方法适合常见的难度不大的化学方程...
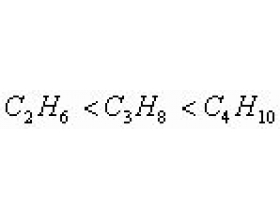 [元素化合物] 常见物质沸点高低的比较规律 作者:化学自习室 来源:未知 日期:2021-03-21 10:16:38 点击:6459 所属专题:沸点
[元素化合物] 常见物质沸点高低的比较规律 作者:化学自习室 来源:未知 日期:2021-03-21 10:16:38 点击:6459 所属专题:沸点
物质沸点高低是由构成物质质点间作用力大小决定的。物质质点间作用力包括分子间作用力和各种化学键。以下从两大方面谈几点比较物质沸点高低的方法。 一. 从分子间作用力大小比较物质沸点高低 1. 据碳原子数判断 对于有机同系物来说,因结构相似,碳原子数越多,分子越大...
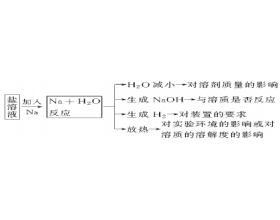 [元素化合物] 元素化合物易错点总结归纳 作者:化学自习室 来源:未知 日期:2021-03-16 08:52:37 点击:818 所属专题:元素化合物 易错点
[元素化合物] 元素化合物易错点总结归纳 作者:化学自习室 来源:未知 日期:2021-03-16 08:52:37 点击:818 所属专题:元素化合物 易错点
一、钠及其化合物的注意防范 (1)金属钠与可溶性盐溶液反应的一种思维模式 (2)钠的性质的2点注意 ①Na及其化合物发生焰色反应时火焰颜色均为黄色,且该变化为物理变化。鉴别Na、K利用焰色反应,二者混合时鉴别K元素要隔着蓝色钴玻璃。 ②无论Na与O 2 反应生成Na 2 O还是Na 2...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。鲍林在研究含氧酸时,将其化学式一般写作 HRO,其中 R 代表中心原子,羟基(–OH)与...
...
一、银47Ag 银亲硫,极化能力强。在自然界中常以自然银、硫化物等形式存在,因其离子...
一、镓Ga 从铝土矿Al 2 O 3 或闪锌矿Zns的冶炼过程中提取,最后经电解制得纯净镓。 门...
一、铁 Fe 古代社会铁器时代大约起始于 前 2000 年 ,最早发现和使用的铁是来自外空的...
一、钪Sc 1、单质是柔软、银白色。熔点1500℃以上。钪常用来制特种玻璃、轻质耐高温合...
一、氢 H 1 、 H ,是原子半径最小的元素,有 H (氕)、 D (氘)、 T (氚)等核素...
一、钠Na 大量存在于海水中,矿物主要有钠长石NaAlSi3O8、岩盐NaCl、钠硝石NaNO3等。 ...