
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑i] 化学反应速率的影响因素及其解释 作者:徐志宏 来源:未知 日期:2017-04-25 16:29:20 点击:39115 所属专题:影响反应速率因素 有效碰撞
[注解与辨疑i] 化学反应速率的影响因素及其解释 作者:徐志宏 来源:未知 日期:2017-04-25 16:29:20 点击:39115 所属专题:影响反应速率因素 有效碰撞
一、化学反应速率的影响因素 主要决定化学反应速率的因素是反应物的性质。影响因素有:浓度、压强、温度、催化剂、表面积、光、超声波、原电池与电解池。 1 、浓度: ① 结论:增加浓度,就加快反应的速率;降低浓度就,减慢反应速率。对于可逆反应,既增 加正反应速率...
 [注解与辨疑i] 化学反应的进行的方向和和化学反应的自发性 作者:何永成 来源:未知 日期:2017-10-26 09:51:53 点击:9582 所属专题:反应方向 自发反应
[注解与辨疑i] 化学反应的进行的方向和和化学反应的自发性 作者:何永成 来源:未知 日期:2017-10-26 09:51:53 点击:9582 所属专题:反应方向 自发反应
一、化学反应进行的方向判定方法 1 、通过正逆反应速率的比较 当 V 正 V 逆 时,平衡朝正反应方向移动。 当 V 正 =V 逆 时,平衡不移动。或反应处在平衡状态。 当 V 正 V 逆 时,平衡朝逆反应方向移动。 2 、可以通过平衡常数 K 的改变判断: 当升高温度, K 值增大,意...
 [注解与辨疑i] 综合看化学工业生产条件的选择 作者:王匆雨 来源:未知 日期:2023-05-16 10:39:25 点击:7172 所属专题:工业条件选择
[注解与辨疑i] 综合看化学工业生产条件的选择 作者:王匆雨 来源:未知 日期:2023-05-16 10:39:25 点击:7172 所属专题:工业条件选择
化学反应总是在一定条件下进行。化学反应速率和化学平衡从两个角度诠释了反应进行的两个方面,一个是快慢问题,一个是转化率问题,而我们研究化学反应尤其是工业反应则应该从这两个方面入手,使生产产品“又快又多”,同时兼顾原料、设备、成本等问题,选择适宜的生产条...
 [注解与辨疑i] 化学反应自发进行的奥秘 作者:邬兆宇 来源:未知 日期:2013-04-16 10:12:45 点击:15692 所属专题:自发反应
[注解与辨疑i] 化学反应自发进行的奥秘 作者:邬兆宇 来源:未知 日期:2013-04-16 10:12:45 点击:15692 所属专题:自发反应
在自然界中,有很多化学反应在一定条件下,无需外界帮助就能自动进行,即能够自发进行,这样的反应称为自发反应,而有些反应却不能自发进行,为何会这样呢?要明白其中的玄机,就要了解判断化学反应方向的依据。 要判断化学反应能否自发进行,首先要了解化学反应发生后,反...
 [注解与辨疑i] 化学平衡常数解析 作者:罗成 来源:未知 日期:2015-12-11 23:23:09 点击:5979 所属专题:化学平衡常数
[注解与辨疑i] 化学平衡常数解析 作者:罗成 来源:未知 日期:2015-12-11 23:23:09 点击:5979 所属专题:化学平衡常数
一、对于一般的可逆反应:mA(g)+nB(g) pC(g)+qD(g),在一定温度下: 。 二、注意事项: 1 、关于 公式 ①反应物或生成物中有固体和纯液体存在时,由于其浓度可看作1而不需要进入平衡常数的表达式。 ②代入公式的浓度必须是平衡时的浓度。 ③正确书写出化学平衡常数的单位...
 [注解与辨疑i] 铬酸根离子和重铬酸根离子的转化 作者:蒋景耘 来源:未知 日期:2013-04-09 10:53:39 点击:71175 所属专题:重铬酸钾 平衡移动
[注解与辨疑i] 铬酸根离子和重铬酸根离子的转化 作者:蒋景耘 来源:未知 日期:2013-04-09 10:53:39 点击:71175 所属专题:重铬酸钾 平衡移动
CrO 4 2- 和Cr 2 O 7 2- 的互相转化,在溶液中CrO 4 2- 同Cr 2 O 7 2- 存在着下列平衡: CrO 4 2- +2H + Cr 2 O 7 2- +H2O 该化学平衡的平衡常数 K=10 14 ,加酸可使平衡向右移动,Cr 2 O 7 2- 离子浓度增大,CrO 4 2- 离子浓度降低,溶液颜色从黄变为橙红;加碱可使平衡左...
 [注解与辨疑i] 自发过程的概念、特征和判断 作者:许雁祥 来源:未知 日期:2013-04-09 08:36:30 点击:28352 所属专题:自发反应
[注解与辨疑i] 自发过程的概念、特征和判断 作者:许雁祥 来源:未知 日期:2013-04-09 08:36:30 点击:28352 所属专题:自发反应
一、 自发过程 自然界的一些过程不必环境对体系做功,就可以自发进行,称为“自发过程” 。 例:水从高处流向低处(可推动水轮机做机械功发电:势能→机械能→电能) 热 高温物体→ 低温物体 电 高电位→ 低电位 Zn(s) + CuSO 4 (aq) → ZnSO 4 (aq) + Cu(s) (可设计为原电...
 [注解与辨疑i] 熵概念的解读 作者:黄惠 来源:未知 日期:2012-12-03 12:57:45 点击:15580 所属专题:熵判据
[注解与辨疑i] 熵概念的解读 作者:黄惠 来源:未知 日期:2012-12-03 12:57:45 点击:15580 所属专题:熵判据
我们知道有些化学反应能发生,而另一些化学反应却不能发生,这是为什么呢?为什么一些化学反应当只有很少一点生成物产生时就达到了平衡,而另一些化学反应却实际上是完全反应了。要弄清以上的问题,需要热力学的知识——特别是应用能与熵的概念和热力学第一定律、第二定...
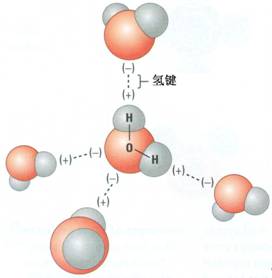 [注解与辨疑i] “惰性”气体对化学平衡的影响 作者:李耀军 来源:未知 日期:2017-04-17 10:30:52 点击:15298 所属专题:惰性气体影响 平衡移动
[注解与辨疑i] “惰性”气体对化学平衡的影响 作者:李耀军 来源:未知 日期:2017-04-17 10:30:52 点击:15298 所属专题:惰性气体影响 平衡移动
此处的“惰性”气体除了指真正意义上的稀有气体外,还指不与平衡体系中任一物质起反应的物质。 (1)等容条件下充入“惰性”气体。表面上引起体系的压强增加,所以极易从压强的变化来分析平衡移动。实际上,压强的影响归根到底还是浓度的影响,恒容条件下充入:气体并未...
 [注解与辨疑i] 怎样理解勒沙特列原理中"减弱"二字? 作者:张超鹏 来源:未知 日期:2012-11-07 09:26:34 点击:3560 所属专题:勒沙特列原理 平衡移动
[注解与辨疑i] 怎样理解勒沙特列原理中"减弱"二字? 作者:张超鹏 来源:未知 日期:2012-11-07 09:26:34 点击:3560 所属专题:勒沙特列原理 平衡移动
可以从定性和定量两个角度分析。 ①定性方面 从定性角度看,平衡移动的方向就是能够减弱外界条件改变的身向。如增大反应物浓度,平衡向正反应方向移动,结果使增大的反应物浓度减...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。什么是能垒、活化能?二者有什么区别? 1、能垒 活化分子含有的能参加化学反应的最低...
1.无论是用某一反应物表示还是用某一生成物表示,由于Δ C 是取浓度变化的绝对值,因...
在一个恒温恒容的密闭容器里,充入2mol SO 2 和1mol O 2 ,发生如下反应并建立化学平...
...
一、人物简介: 阿伦尼乌斯·斯万特·奥古斯特(1859年2月19日~1927年10月2日)瑞典物...
本题考查了阿伦尼乌斯公式中温度和速率常数的关系,即温度升高,速率常数变大。 本题...
工业生产中适宜生产条件的选择原则 : (1)从化学反应速率分析:既不能过快,也不能...
化学反应总是在一定条件下进行。化学反应速率和化学平衡从两个角度诠释了反应进行的两...