
|
学习小专题 |

|
学习小专题 |
 [方法与规律a] 比较元素金属性和非金属性强弱的依据 作者:秦文鑫 来源:未知 日期:2016-01-24 18:32:25 点击:35223 所属专题:金属性 非金属性
[方法与规律a] 比较元素金属性和非金属性强弱的依据 作者:秦文鑫 来源:未知 日期:2016-01-24 18:32:25 点击:35223 所属专题:金属性 非金属性
一、比较元素金属性强弱的依据 金属性——金属原子在气态时失去电子能力强弱(需要吸收能量)的性质 金属活动性——金属原子在水溶液中失去电子能力强弱的性质 注:“金属性”与“金属活动性”并非同一概念,两者有时表示为不一致,如Cu和Zn:金属性是:Cu Zn,而金属活...
 [方法与规律a] 微粒半径比较的“三步曲” 作者:黄贞帧 来源:未知 日期:2012-11-24 14:57:45 点击:5845 所属专题:半径比较
[方法与规律a] 微粒半径比较的“三步曲” 作者:黄贞帧 来源:未知 日期:2012-11-24 14:57:45 点击:5845 所属专题:半径比较
微粒半径大小比较规律繁多,很容易记混., 微粒半径比较的三步法,思路清晰,容易识记,现把微粒半径比较的三步曲介绍如下: 第一步:比较核外电子层数,一般情况下,微粒的电子层数越多,半径越大。 如r(Li) r(Na) r(K)r(Rb) ,r(Li + ) r(Na + ) r(K + )r(Rb + ),r(F - ) r(Cl...
 [方法与规律a] 常见的等电子微粒及在解题中的应用 作者:王瑜 来源:未知 日期:2016-01-24 18:34:33 点击:4084 所属专题:10电子 18电子
[方法与规律a] 常见的等电子微粒及在解题中的应用 作者:王瑜 来源:未知 日期:2016-01-24 18:34:33 点击:4084 所属专题:10电子 18电子
一、 10 电子微粒 常见的有: NH 4 + 、 NH 3 、 NH 2 — 、 NH 2 — 、 N 3 — ; H 3 O + 、 H 2 O 、 OH — 、 O 2 — ; HF 、 F — 、 Ne 、 Na + 、 Mg 2+ 、 Al 3+ ; H 3 C — 、 CH 4 、 CH 5 + 等。 二、 14 电子微粒 Si 、 N 2 、 HC ≡ CH 、 [C ≡ C] 2 —...
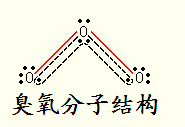 [方法与规律a] 区分极性分子和非极性分子的几种方法 作者:李耀军 来源:未知 日期:2016-01-30 12:47:09 点击:59300 所属专题:分子极性
[方法与规律a] 区分极性分子和非极性分子的几种方法 作者:李耀军 来源:未知 日期:2016-01-30 12:47:09 点击:59300 所属专题:分子极性
1 、中心原子化合价法 : 组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子.如:CH 4 ,CCl 4, SO 3, PCl 5 2 、受力分析法 : 若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子.如:CO 2 ,C 2 H 4 ,BF 3 3 、非极性分子: 同种原子...
 [方法与规律a] “10电子”、“18电子”的微粒小结 作者:林夕 来源:未知 日期:2014-11-25 09:57:37 点击:3358 所属专题:10电子 18电子
[方法与规律a] “10电子”、“18电子”的微粒小结 作者:林夕 来源:未知 日期:2014-11-25 09:57:37 点击:3358 所属专题:10电子 18电子
(一)“10电子”的微粒: 分子 离子 一核10电子的 Ne N 3 、O 2 、F 、Na + 、Mg 2+ 、Al 3+ 二核10电子的 HF OH 、 三核10电子的 H 2 O NH 2 四核10电子的 NH 3 H 3 O + 五核10电子的 CH 4 NH 4 + (二)“18电子”的微粒 一核18电子的 Ar K + 、Ca 2+ 、Cl ̄、S 2 二核18...
 [方法与规律a] 比较元素金属性强弱的八种方法 作者:单莹 来源:未知 日期:2012-09-19 09:32:53 点击:18486 所属专题:金属性
[方法与规律a] 比较元素金属性强弱的八种方法 作者:单莹 来源:未知 日期:2012-09-19 09:32:53 点击:18486 所属专题:金属性
元素的金属性是指元素的原子失电子能力,判断元素金属性强弱,主要可从以下几方面来判断。 一、依金属活动顺序表判断 金属活动顺序表中,一般位置越后的金属,金属性越弱,原子的还原性越弱。 例外:金属活动性:SnPb,但元素的金属性: Pb Sn。 二、依元素周期表判断 1.同...
 [方法与规律a] 元素非金属性的强弱规律 作者:吴琼 来源:未知 日期:2012-09-14 16:11:45 点击:2805 所属专题:非金属性
[方法与规律a] 元素非金属性的强弱规律 作者:吴琼 来源:未知 日期:2012-09-14 16:11:45 点击:2805 所属专题:非金属性
...
 [方法与规律a] 元素在周期表中位置推导的方法归纳 作者:唐艳玲 来源:未知 日期:2012-12-03 10:55:11 点击:7616 所属专题:元素位置
[方法与规律a] 元素在周期表中位置推导的方法归纳 作者:唐艳玲 来源:未知 日期:2012-12-03 10:55:11 点击:7616 所属专题:元素位置
1、根据原子序数推导 首先记住各周期的元素种类,按照2、8、8、18、18、32、32、50(分别为1的平方的2倍,2的平方的2倍,3的平方的2倍......),可得出每周期的0族元素的原子序数分别为:2、10、18、36、54、86、118.......)然后根据原子序数即可推出此元素在周期表中...
 [方法与规律a] 怎样判断化学键的类型 作者:康建峰 来源:未知 日期:2012-12-03 10:55:46 点击:15617 所属专题:化学键
[方法与规律a] 怎样判断化学键的类型 作者:康建峰 来源:未知 日期:2012-12-03 10:55:46 点击:15617 所属专题:化学键
通常情况下,除稀有气体外,所有元素的原子的电子层结构均不甚稳定。它们通过电子得失或电子共用,以达到比较稳定的结构。从而形成化学键,结合成聚集体。化学键主要有离子键、共价键和金属键。 1.离子键 是阳离子和阴离子间通过静电引力所形成的化学键。当活泼金属和...
 [方法与规律a] 原子结构方面的一般与特殊 作者:陈万 来源:未知 日期:2012-03-05 17:56:00 点击:4400 所属专题:原子结构03
[方法与规律a] 原子结构方面的一般与特殊 作者:陈万 来源:未知 日期:2012-03-05 17:56:00 点击:4400 所属专题:原子结构03
1、原子均有质子、中子、电子构成,但H、H + 、H - 等微粒没有中子。 2、零族元素一般都在P区,但He元素在S区。 3、主族元素的价电子数=最外层电子数=外围电子数=主族序数=最高正价,但O、F例外。 4、电子排布遵循能量:3d>4s,但失电子顺序则是先失4s电子后失3d电子,如Fe...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、推理方法 1 、利用原子周围的键数推理出原子的最外层电子数,定位可能的元素。 (...
元素推断题是高考考查的热点,这类题往往将元素化合物的知识、物质结构理论、化学基本...
一:形成8电子稳定结构的元素特点: 当最外层电子数M层小于4时,次外层应为8电子。 当...
一、高考再现 〔2019全国I卷〕科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z...
本次大会出现的一些高频词汇涉及了很多化学知识,通过本文带你认识化学知识与生活实际...
离子的半径(以离子半径的单位为10-10m): 1.同种元素原子与离子比较,阴离子半径原子半...
⑴ 已知原子结构示意图,可以根据下列等式来推: 电子层数 = 周期数 最外层电子数 = ...
一、电子层容量原理 在原子核外电子排布中,每个电子层最多容纳的电子数为2 n 2 ,这...