
|
学习小专题 |

|
学习小专题 |
 [方法与规律h] 循环图中催化剂的判断 作者:化学自习室 来源:未知 日期:2025-01-06 10:08:26 点击:419 所属专题:循环图 催化剂
[方法与规律h] 循环图中催化剂的判断 作者:化学自习室 来源:未知 日期:2025-01-06 10:08:26 点击:419 所属专题:循环图 催化剂
环状反应历程图分析大概思路: 1、环上——催化剂或中间体(图中⑤⑥⑦⑧) 2、入环——反应物(图中①④) 3、出环——生成物(图中②③) 同时比较入环与出环若为同一种物质,则为催化剂。 分析: 整个过程来看,4个NH 3 失去了2个电子后生成了1个N 2 H 4 和2个 NH 4 + ,R...
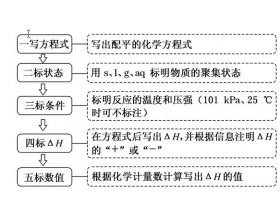 [方法与规律h] 热化学方程式的书写五个步骤六个注意事项 作者:化学自习室 来源:未知 日期:2024-09-12 15:05:48 点击:247 所属专题:热化学方程式
[方法与规律h] 热化学方程式的书写五个步骤六个注意事项 作者:化学自习室 来源:未知 日期:2024-09-12 15:05:48 点击:247 所属专题:热化学方程式
注意1、热化学方程式与普通方程式中的计量数是有区别的,热化学方程式的计量数可以是分数。 注意2、由于物质的能量与物质的状态相关,所以在热化学方程式中,必须用符号标出物质的聚集态。 s、l、g、aq四种符号分别表示固、液、气、溶液四种状态。注意l表示是纯净物,aq表示...
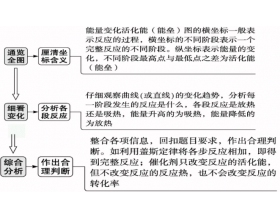 [方法与规律h] 三步突破能量变化活化能(能垒)图 作者:化学自习室 来源:未知 日期:2024-04-26 08:19:13 点击:553 所属专题:能垒
[方法与规律h] 三步突破能量变化活化能(能垒)图 作者:化学自习室 来源:未知 日期:2024-04-26 08:19:13 点击:553 所属专题:能垒
...
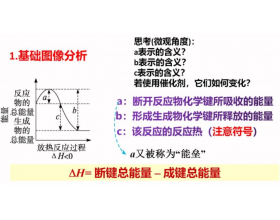 [方法与规律h] 能量与反应过程图像分析 作者:化学自习室 来源:未知 日期:2024-04-26 07:57:02 点击:2933 所属专题:反应能量图像
[方法与规律h] 能量与反应过程图像分析 作者:化学自习室 来源:未知 日期:2024-04-26 07:57:02 点击:2933 所属专题:反应能量图像
方法技巧 解答能量变化图像题需要注意的几点。 (1)反应热不能取决于部分反应物能量和部分生成物能量的相对大小,即部分反应物能量和部分生成物能量的相对大小不能决定反应是吸热还是放热。 (2)注意活化能在图示(如下图)中的意义。 ①从反应物至最高点的能量变化(E1)表示...
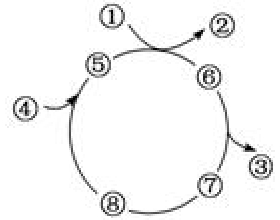 [方法与规律h] 物质循环转化图的解题方法 作者:化学自习室 来源:未知 日期:2022-03-15 17:11:20 点击:2594 所属专题:循环图
[方法与规律h] 物质循环转化图的解题方法 作者:化学自习室 来源:未知 日期:2022-03-15 17:11:20 点击:2594 所属专题:循环图
对于“环式”反应过程图像可表示为: (1)位于“环上”的物质一般是催化剂或中间体,如⑤、⑥、⑦、⑧;上题中MgOCO 2 、MgOCOOH、MgOCO、MgOCOOH、MgOC、MgOCH、MgOCH 2 、MgOCH 3 均为中间产物,而MgO是催化剂(加入后又生成)。 (2)“入环”的物质为反应物,如①和④;...
 [方法与规律h] 热化学方程式的书写、判断及应用 作者:化学自习室 来源:未知 日期:2021-08-18 17:03:06 点击:1800 所属专题:热化学方程式
[方法与规律h] 热化学方程式的书写、判断及应用 作者:化学自习室 来源:未知 日期:2021-08-18 17:03:06 点击:1800 所属专题:热化学方程式
一、定义 表示化学反应中吸收或放出的热量的化学方程式。 注意: 1、热化学方程式不仅可以表示化学反应过程中的物质变化,也可以表示反应中的能量变化。 2、中学化学中的四大守恒定律:质量守恒:所有反应都遵守。能量守恒:所有反应都遵守。得失电子守恒:氧化还原反应...
 [方法与规律h] 反应热计算中的图解与变式 作者:化学自习室 来源:未知 日期:2021-08-15 12:08:29 点击:690 所属专题:反应热计算
[方法与规律h] 反应热计算中的图解与变式 作者:化学自习室 来源:未知 日期:2021-08-15 12:08:29 点击:690 所属专题:反应热计算
盖 斯(Gormain Henri Hess l802-1850)1802年8月8日生于瑞士日内瓦市一位画家家庭,三岁时随父亲定居俄国莫斯科, 1825年毕业于多尔帕特大学医学系,并取得医学博士学位。1826年弃医专攻化学,并到瑞典斯德哥尔摩柏济力阿斯实验室进修化学,从此与柏济力阿斯结成 了深...
 [方法与规律h] 怎样判断热化学方程式正误? 作者:化学自习室 来源:未知 日期:2020-07-16 16:14:12 点击:1032 所属专题:热化学方程式
[方法与规律h] 怎样判断热化学方程式正误? 作者:化学自习室 来源:未知 日期:2020-07-16 16:14:12 点击:1032 所属专题:热化学方程式
1.检查是否标明聚集状态:固(s)、液(l)、气(g) 2.检查△H的“+”“-”是否与吸热、放热一致。(注意△H的“+”与“-”,放热反应为“-”,吸热反应为“+”) 3.检查△H的数值是否与反应物或生成物的物质的量相匹配(成比例) 注意: ⑴要注明反应温度和压强,...
 [方法与规律h] 反应热计算方法 作者:化学自习室 来源:未知 日期:2020-04-26 19:59:17 点击:2424 所属专题:反应热计算
[方法与规律h] 反应热计算方法 作者:化学自习室 来源:未知 日期:2020-04-26 19:59:17 点击:2424 所属专题:反应热计算
一、比例法 热量的求算:化学计量数与△H绝对值成正比 例10.3mol的气态高能燃料乙硼烷( )在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,写出其热化学方程式_______________________。解析:根据书写热化学方程式的要求,写出热化学方程式并配平: 可列...
 [方法与规律h] 突破内能、键能、活化能与能量图像分析 作者:化学自习室 来源:未知 日期:2020-02-21 12:13:32 点击:83498 所属专题:反应能量图像
[方法与规律h] 突破内能、键能、活化能与能量图像分析 作者:化学自习室 来源:未知 日期:2020-02-21 12:13:32 点击:83498 所属专题:反应能量图像
一、内能的含义 1、微观定义 从微观上说,系统内能是构成系统的所有分子无规则运动动能、分子间相互作用势能、分子内部以及原子核内部各种形式能量的总和。后面两项在大多物理过程中不变,因此一般只需要考虑前两项,二者的总和就是通常所指的内能。但在涉及电子的激发、电...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、热化学方程式的书写 与普通化学方程式相比,书写热化学方程式除了遵循书写普通化...
2017年高考化学考试说明中特别增加了一条:了解反应活化能的概念,了解催化剂的重要作...
方法技巧 解答能量变化图像题需要注意的几点。 (1)反应热不能取决于部分反应物能量和...
对于“环式”反应过程图像可表示为: (1)位于“环上”的物质一般是催化剂或中间体,如...
一、定义 表示化学反应中吸收或放出的热量的化学方程式。 注意: 1、热化学方程式不仅...
盖 斯(Gormain Henri Hess l802-1850)1802年8月8日生于瑞士日内瓦市一位画家家庭,...
盖斯定律:实际上就是焓变的 加减 (概念:化学反应分成 二步 或 分几步 完成,总反应...
1.检查是否标明聚集状态:固(s)、液(l)、气(g) 2.检查△H的“+”“-”是否与...