
|
学习小专题 |
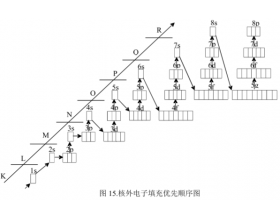 原子核外电子排布规则解读
日期:2021-12-17 10:20:31
点击:24115
好评:4
原子核外电子排布规则解读
日期:2021-12-17 10:20:31
点击:24115
好评:4
1、Pauli不相容原理:每个轨道最多只能容纳两个电子,且自旋相反配对 2、能量最低原理:电子尽可能占据能量最低的轨道 3、Hund规则:简并轨道(能级相同的轨道)只有被电子逐一自旋平行地占据后,才能容纳第二个电子 另外:等价轨道在全充满、半充满或全空的状态是比较...
 原子核外电子排布情况的推断
日期:2021-12-17 09:38:30
点击:7116
好评:1
原子核外电子排布情况的推断
日期:2021-12-17 09:38:30
点击:7116
好评:1
原子核外电子的排布情况与其化学性质密切相关。所以了解原子核外电子排布情况一直是各级化学教学中的一个重点,在无机化学及普通化学教学中也不例外。 对比一下比较有影响的一些无机化学教材就可以发现,在说明这个问题时,它们都用到了两个图。一个是鲍林的“原子轨道...
 原子核外电子排布规律解析
日期:2021-12-17 09:37:38
点击:1260
好评:0
原子核外电子排布规律解析
日期:2021-12-17 09:37:38
点击:1260
好评:0
...
 核外电子排布的原理
日期:2021-12-17 09:07:10
点击:9487
好评:0
核外电子排布的原理
日期:2021-12-17 09:07:10
点击:9487
好评:0
一、最低能量原理 所谓最低能量原理是,原子核外的电子,总是尽先占有能量最低的原子轨道,只有当能量较低的原子轨道被占满后,电子才依次进入 能量较高的轨道,以使原子处于能量最低的稳定状态。 原子轨道能量的高低为: 1.当n相同,l不同时,轨道的能量次序不s<p<d...
1. 排布原则 1) 能量最低原理 电子由能量低的轨道向能量高的轨道排布(电子先填充能量低的轨道,后填充能量高的轨道. 2) Pauli(保利)不相容原理 每个原子轨道中只能容纳两个自旋方向相反的电子(即同一原子中没有运动状态完全相同的电子,亦即无四个量子数完全相同的电子). ...
 原子核外电子排布规则及应用
日期:2021-12-17 09:03:35
点击:1748
好评:0
原子核外电子排布规则及应用
日期:2021-12-17 09:03:35
点击:1748
好评:0
1. 排布原则 (没有2 n 2 ,没有最外层限制等等,一切自然而然就出现了!) 1) 能量最低原理 电子由能量低的轨道向能量高的轨道排布,即电子先填充能量低的轨道,后填充能量高的轨道。 2) Pauli(保利)不相容原理 每个原子轨道中只能容纳两个自旋方向相反的电子,即同一...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。