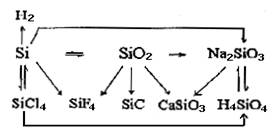
一、掌握硅单质及其化合物的性质 其主要性质可通过下列网络图体现(写出的方程式越多,说明性质掌握的越全面)。 二、注意硅与碳的比较 原子半径:r(硅)>r(碳),氧化性:碳>硅,还原性:硅>碳。 晶体单质:都为原子晶体,熔、沸点都很高,硬度都很大。但两晶体
一、掌握硅单质及其化合物的性质
其主要性质可通过下列网络图体现(写出的方程式越多,说明性质掌握的越全面)。
二、注意硅与碳的比较
原子半径:r(硅)>r(碳),氧化性:碳>硅,还原性:硅>碳。
晶体单质:都为原子晶体,熔、沸点都很高,
硬度都很大。但两晶体相比较,碳单质的熔、沸点更高,硬度更大(
键长不等)。
氧化物:二氧化碳固体是分子晶体,二氧化硅是原子晶体。氧化物的化学式相同,但
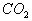
表示二氧化碳的分子组成,
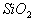
不表示二氧化硅的分子组成,仅表示二氧化硅晶体中硅与氧的个数比为1:2。
含氧酸:碳酸是不稳定的弱酸,硅酸是难溶的固态弱酸,原硅酸是难溶的不稳定的固态弱酸。碳酸不能生成多碳酸,硅酸可以生成多硅酸。
三. 掌握硅及其化合物的特性
1. 硅的还原性比碳强,但碳在高温下能从二氧化硅中还原出硅。
2. 非金属单质一般不与非
氧化性酸反应,而硅不但与
氢氟酸反应,而且有氢气生成。
3. 非金属单质与强碱反应一般不生成氢气,而硅与强碱反应有氢气生成。
4. 酸性氧化物一般不与酸发生复分解反应,而二氧化硅可与氢氟酸反应。
5. 无机酸一般可溶于水,而硅酸和原硅酸都是难溶于水的弱酸。
6. 碳酸的酸性比硅酸强,
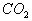
与硅酸钠反应生成碳酸钠和硅酸沉淀。在高温下碳酸钠、碳酸钙可分别与
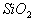
反应生成硅酸钠、硅酸钙。
四、注意两个重要反应
1.
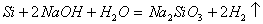
,当要标电子转移数目时,方程式两边需要各加
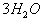
,且要知道水为氧化剂,
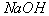
既不是氧化剂也不是还原剂。
2.
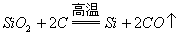
,不能说明碳的还原性比硅强。
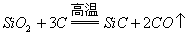
,在这个反应中,氧化剂与还原剂的物质的量之比是1:2,同时也说明碳的氧化性比硅强。
五、注意一些经典试题
1. 有关硅、二氧化硅以及同族碳元素形成的金刚石、干冰、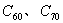 、二氧化碳、
、二氧化碳、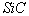 等结构方面的试题
等结构方面的试题。
练习1:假设科学家合成出由100个硅原子构成具有完美对称性的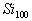 分子,最内层是由20个硅原子构成的正12面体,外层的60个硅原子构成12个独立的正五边形,处于中间层次的20个硅原子将内、外层硅原子连接在一起,当
分子,最内层是由20个硅原子构成的正12面体,外层的60个硅原子构成12个独立的正五边形,处于中间层次的20个硅原子将内、外层硅原子连接在一起,当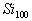 与足量氢气完全反应时,每个硅原子形成4个共价单键,其产物的分子式应为( )
与足量氢气完全反应时,每个硅原子形成4个共价单键,其产物的分子式应为( )
2. 有关新型材料试题。
练习2:化学研究的目标之一是发现和研制特殊功能的新材料。
碳化硅纤维是由聚二甲基
硅烷在400℃下加热,制备成碳原子和硅原子交替排列的一条长链的物质,然后该物质放在氮气气氛中在1200℃左右的温度下缓慢加热而形成的。该两步反应的化学方程式是____________和____________。氮化硅薄膜材料是由甲硅烷与氨气在900℃到1100℃温度下反应而制成的,其化学反应方程式是________________________。这两种材料的晶体都属于____________晶体,它们最显著的特性为____________和____________。
3. 多硅酸形成方面的试题。
练习3:原硅酸分子之间可以相互作用而脱水,其反应为:
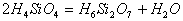
,推断产物
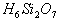
的结构式为____________,其分子中含硅氧键____________个。原硅酸分子之间可以相互脱水生成多硅酸,若多硅酸根中硅原子为n,则离子符号为____________。
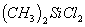
可水解,写出
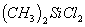
与
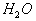
作用,生成硅橡胶
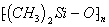
的反应方程式______________。
参考答案:
练习1:A
练习2:
原子 熔点高 硬度大
练习3:
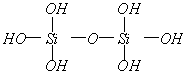 8
8 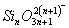
(责任编辑:化学自习室)


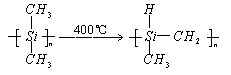
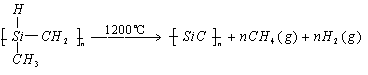
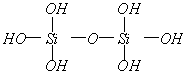 8
8 
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。