
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、粒子半径大小规律
1. 原子半径大小规律
原子是由原子核和核外电子构成的。原子半径的大小决定于原子核和核外电子之间的静电作用的强弱。其强弱由两个因素共同决定:①核电荷数越大,核对外层电子的引力增大,原子半径减小;②电子层越多又削弱了原子核对最外层电子的引力,使原子半径增大。对于同一周期元素,两种因素以①为主,对于同一主族元素,两种因素以②为主。故规律为:
(1)同一周期主族元素的原子从左到右半径依次减小。如r(Na)>r(Mg)>r(Al)。(即左大右规律)。
(2)同一主族元素从上到下的原子半径依次增大。如r(F)<r(Cl)<r(Br)<r(I)。(即下大上规律)。
点评:①以上规律只适用主族元素。②由于惰性元素原子半径与主族元素原子半径测定方式不同,故上述规律不包括惰性元素原子。
2. 离子半径大小规律
在离子晶体中,阴阳离子核间距等于阴阳离子的半径之和;而原子核与核外电子的静电引力大小决定离子半径大小的变化规律。
(1)阳离子半径小于相应的原子半径。如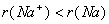 。(即阳小原规律)
。(即阳小原规律)
(2)阴离子半径大于相应的原子半径。如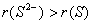 。(即阴大原规律)
。(即阴大原规律)
(3)在同一周期中,电子层结构相同的阳离子从左到右,由于离子所带的正电荷数逐渐增多,离子半径逐渐减小。
如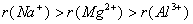 。而电子层结构相同的阴离子,由于离子所带的负电荷数逐渐减少,离子的半径也逐渐减小。
。而电子层结构相同的阴离子,由于离子所带的负电荷数逐渐减少,离子的半径也逐渐减小。
如: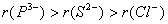 。(即左大右规律)。
。(即左大右规律)。
(4)具有相同电子层结构的离子,核电荷数越大其离子半径越小。
如: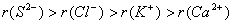 。
。
二、隐含性质规律
1. 原子半径隐含性质规律
(1)在主族元素中,原子半径越大,失电子能力越强,还原性越强,金属性越强;半径越小得电子能力越强,氧化性越强,非金属性越强。因此在同一周期从左到右金属性由强渐弱,非金属性由弱渐强;同一主族从上到下金属性渐强,非金属性渐弱。如左下角钫(Fr),半径最大,金属性最强;左上角的氟(F),半径最小,氧化性最强等。
(2)对于金属元素的原子,半径越小形成金属晶体时金属键就越强,熔沸点越高;反之越低。如碱金属中熔沸点从上到下逐渐减小,同一周期金属的熔沸点逐渐升高。对于非金属元素的原子在形成氢化物时,原子半径越大,键能越小,其稳定性越弱,氢化物水溶液的酸性越强。如卤素中稳定性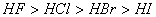 ,水溶液的酸性
,水溶液的酸性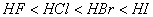 。在形成原子晶体时,一般来讲原子半径越小,键长越短,键能越大,共价键越牢固,晶体的熔沸点越高。如金刚石(C—C)>晶体硅(Si—Si)(待学)。
。在形成原子晶体时,一般来讲原子半径越小,键长越短,键能越大,共价键越牢固,晶体的熔沸点越高。如金刚石(C—C)>晶体硅(Si—Si)(待学)。
2. 离子半径隐含性质规律
(1)对于金属阳离子,离子半径越大,与OH-离子结合能力越弱,则碱性越强。如碱性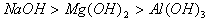 。对于非金属阴离子,离子半径越大,失电子能力越强,则还原性越强。如:
。对于非金属阴离子,离子半径越大,失电子能力越强,则还原性越强。如: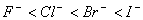 。
。
(2)对于阴阳离子构成的离子化合物,离子半径越大,其离子键越弱,熔沸点就越低。如:熔沸点: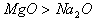 ,
,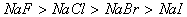 。
。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、推理方法 1 、利用原子周围的键数推理出原子的最外层电子数,定位可能的元素。 (...
元素推断题是高考考查的热点,这类题往往将元素化合物的知识、物质结构理论、化学基本...
一:形成8电子稳定结构的元素特点: 当最外层电子数M层小于4时,次外层应为8电子。 当...
一、高考再现 〔2019全国I卷〕科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z...
本次大会出现的一些高频词汇涉及了很多化学知识,通过本文带你认识化学知识与生活实际...
离子的半径(以离子半径的单位为10-10m): 1.同种元素原子与离子比较,阴离子半径原子半...