
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一些辅导材料认为,原子晶体在熔融时破坏共价键.因此可以通过晶体中共价键的键能 大小,判断原子晶体的熔点。选取方石英SiO2、金刚石、碳化硅、单质晶体硅四种较为典型的原子晶体的正当晶胞及熔点如下。
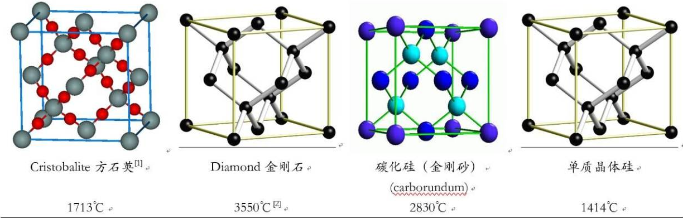
[1]石英有多晶体结构,熔点各不相同,选方石英为代表,用其余结构的数据也不影响后续讨论。
[2]数值与压力有关;而且在压力不太高(约0.01〜1 G Pa;1 G Pa=109Pa数量级)时,其融化涉及到与石墨之前的相变,而且存在亚稳定区;而压力低于0.01G Pa时,将不经过液态直接升华。所以这个数据严格来讲与其他数据 不具有严格可比性,但是仍有一定参考意义,故拿来使用。
观察上述晶体结构图,不难发现金刚石与晶体硅的结构完全相同,只是把Si原子换成 了 C原子;若将金刚石中半数的C原子换成Si,就得到了SiC晶体;而方石英则是在晶体硅的基础上,每两个Si原子之间插入一个O原子。
在方石英中,1个Si与4个O形成共价键,因此1 mol SiO2晶体中有4 mol Si—O键 (上图每个晶胞中有8个Si,因此共32个Si—O键);同理,1 mol 金刚石晶体中有2 mol C一C键,一个晶胞中有16 mol C—C键;1 mol 碳化硅晶体中有4 mol Si—C键,一个晶胞 中有16 mol Si—C键;1 mol 硅晶体中有2 mol Si—Si键,一个晶胞中有16 mol Si—Si键。
![]()
不难发现,键能的顺序与熔点顺序并不完全一致,对于金刚石、碳化硅和晶体硅的熔点顺序与键能大小顺序是一致的,而问题就出在了 SiO2晶体。如果根据键能,无论以何种单位做参照,SiO2的熔点理应高于SiC,实际却低了 1000°C以上(所有数据来源都是如此)。
此时逻辑思维敏锐的同学就会认识到,问题只能出在我们的比较方法——即我们在用键能比较熔点时,有一个隐含的逻辑起点,而这个起点未必总是成立的。即原子晶体熔化时, 并不是破坏全部共价键。这点很好理解
原子晶体→液态→气态原子
由晶体到气体,共价键才被完全破坏,液态作为二者的过渡状态,必然存在着共价键的残余。而晶体结构相同的物质,在熔化时,破坏共价键的百分比是近似相同的,因此键能就可以代表熔化难易;而SiO2由于插入了 O原子,使得晶体中的环结构变大(由六元环到十二元环),本身"刚性”(我找不到合适的词汇)就较弱,熔化时只需要破坏少部分化学键即可
这提醒我们,必须熔化前、后的结构、作用力变化相似的晶体,才可以用键能比较熔点。例如试图用“键”的观点,比较金属钨W和刚玉熔点,显然是荒谬的。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、面心立方最密堆积 面心立方最密堆之中,八面体间隙位于 棱 心和体心,如上图可知...
1. Cu 、Fe交错 一种CuFeS 2 (黄铜矿)的 四方晶系 晶胞结构如图。 如果将该晶体中的...
在目前有些资料中,提及石墨中含有金属键。下面我们通过4种版本(人教版、鲁科版、苏...
金刚石硬度比石墨大得多,缘于金刚石的“均匀一体化”的空间网状结构,无论从哪个方向...
键能,常见有共价键的键能:使1mol 某共价键断裂所需的能量(键焓,kJ/mol)。 不说离子...
01原子结构 HCP,即密排六方晶格(Hexagonal Close Packed),是晶体结构的一种,其原...