
|
学习小专题 |
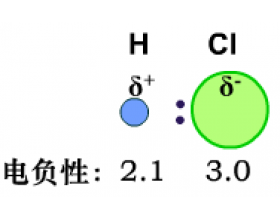 第二十讲:分子结构与性质(二)范德华力分子结构与性质的关系
日期:2022-08-06 10:24:24
点击:14257
好评:0
第二十讲:分子结构与性质(二)范德华力分子结构与性质的关系
日期:2022-08-06 10:24:24
点击:14257
好评:0
三、键的极性、分子的极性、范德华力、氢键 1、键的极性 共价键分为极性键和非极性键。极性是因为键的两端的原子带正负电荷,是由于共用电子对的偏移引起的。在电负性中,我们知道不同元素的原子对键合电子的吸引力不同。这会导致不同元素的原子形成的共价键的共用电子对会...
 化学速成班:极性键与非极性键
日期:2021-03-22 16:29:13
点击:154
好评:0
化学速成班:极性键与非极性键
日期:2021-03-22 16:29:13
点击:154
好评:0
化学速成班:极性键与非极性键。...
 极性键和非极性键怎么判断
日期:2020-06-18 07:50:43
点击:3566
好评:0
极性键和非极性键怎么判断
日期:2020-06-18 07:50:43
点击:3566
好评:0
极性键和非极性键的区别 (1) 非极性键:同种原子形成共价键,两个原子吸引电子的能力相同,共同电子对不偏向任何一个原子,电荷在两个原子核附近对称地分布,因此成键的原子都不显电性。这样的共价键称为非极性键。 判断方法:由相同元素的原子形成的共价键是非极性键。如单...
 共价键极性强弱与电解质强弱是否一致?
日期:2019-11-11 16:55:15
点击:1302
好评:0
共价键极性强弱与电解质强弱是否一致?
日期:2019-11-11 16:55:15
点击:1302
好评:0
从物质结构观点来看,电解质一定是离子化合物或含极性键 的共价化合物。对于后者,电解质的强弱与共价键的极性虽有一 定的联系,但绝不能得出共价键极性越强,电解质就越强的结论。 仅举下列事实加以说明: (1) 含有强极性键的非电解质 乙醇、蔗糖均含极强极性的O—H键,NH...
 键的极性与键的种类判断
日期:2016-04-19 09:41:27
点击:6408
好评:0
键的极性与键的种类判断
日期:2016-04-19 09:41:27
点击:6408
好评:0
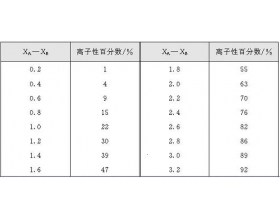
在共价化合物中,由于不同元素的原子吸引电子的能力不同,共用电子对就必然或多或少地偏向于对它吸引力较大的那个原子(即电子云密度大的地方将偏近于这个原子),所以形成的键就具有不同程度的极性。两种元素的电负性相差越大,它们之间键的极性就越强,其中,电负性较大的原...
 臭氧分子中的键有极性吗?
日期:2016-01-21 12:36:10
点击:26994
好评:2
臭氧分子中的键有极性吗?
日期:2016-01-21 12:36:10
点击:26994
好评:2
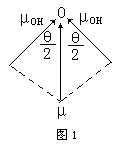
当前,就臭氧分子中的键是否有极性问题在中学化学教师中有两种截然不同的看法。一种认为,臭氧分子中的键无极性。理由是化学键的极性是由两个成键原子吸引电子的能力不同或电负性差值决定的,差值为零,共用电子对不偏向任何一个原子,为非极性键。另一种则认为,臭氧...
 怎样讲述键的极性
日期:2012-12-03 11:33:14
点击:17720
好评:0
怎样讲述键的极性
日期:2012-12-03 11:33:14
点击:17720
好评:0
在现行高中化学课本中,有关极性键和非极性键的概念是这样阐述的:在单质分子中,同种原子形成的共价键,两个原子吸引电子的能力相同,共用电子对不偏向任何一个原子,这两个电子在键的中央出现的机会最多,成键的原子都不显电性。这样的共价键叫做非极性共价键,简称...
 决定共价键极性强弱的因素
日期:2012-12-03 10:57:50
点击:23517
好评:0
决定共价键极性强弱的因素
日期:2012-12-03 10:57:50
点击:23517
好评:0
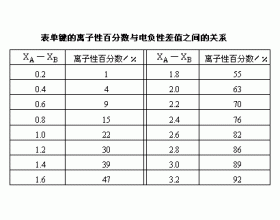
在共价化合物中形成弱极性键或强极性键是由哪些因素来决定的?电负性差值达到什么程度,极性键就转变为离子键? 在共价化合物中,由于不同元素的原子吸引电子的能力不同,共用电子对就必然或多或少地偏向于对它吸引力较大的那个原子(即电子云密度大的地方将偏近于这个...
 动画演示:极性键与非极性键
日期:2012-11-27 20:03:06
点击:361
好评:0
动画演示:极性键与非极性键
日期:2012-11-27 20:03:06
点击:361
好评:0
...
 臭氧分子中的键有极性吗?
日期:2012-10-26 20:17:07
点击:415
好评:0
臭氧分子中的键有极性吗?
日期:2012-10-26 20:17:07
点击:415
好评:0
臭氧分子中的键有极性吗?...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。