
|
学习小专题 |
 电镀锌时为何Zn2+比H+容易获得电子?
日期:2024-04-15 08:23:36
点击:9282
好评:0
电镀锌时为何Zn2+比H+容易获得电子?
日期:2024-04-15 08:23:36
点击:9282
好评:0
高中化学课本主要内容是:以ZnCl 2 为电镀液,在铁制品上镀一层锌.学生在学习这部分内容时常常提问:在阴极,为什么Zn 2+ 比H + 容易获得电子?课本指出:在电镀所控制的条件下,电镀液中H + 一般不起反应.由于受中学教材的限制,课本对电镀所控制的条件究竟是什么以...
 镀锌实验中Zn2+、H+在阴极放电顺序的讨论
日期:2022-08-06 15:36:46
点击:12024
好评:0
镀锌实验中Zn2+、H+在阴极放电顺序的讨论
日期:2022-08-06 15:36:46
点击:12024
好评:0
现行高级中学教科书化学第三册 (选修)中的镀锌实验:以铁片(镀件)作阴极、锌片(镀层金属)作阳极,电镀液是0.1molL-1的ZnCl2水溶液.当外接直流电通入两电极,电解质溶液中向阴极移动的阳离子有Zn2+和H+两种.究竟哪一种离子在阴极上先放电(即得到电子被还原) 呢? 对此...
 实验模拟:电镀
日期:2016-04-19 13:43:14
点击:415
好评:0
实验模拟:电镀
日期:2016-04-19 13:43:14
点击:415
好评:0
...
 为什么在塑料上也能电镀?
日期:2014-06-25 23:05:11
点击:5705
好评:0
为什么在塑料上也能电镀?
日期:2014-06-25 23:05:11
点击:5705
好评:0
一般所说的电镀,是指在基体金属(如铁、铜等)上面镀上一层薄薄的金属(如铬、镍等),目的是为了增强各种金属物品的防腐性能、耐磨性能,同时使它们更美观。随着社会的发展,电镀的应用也越来越广,人们对电镀的要求就不局限于在金属物品上镀金属,而考虑到也要在非金...
 关于电镀阳极材料选择
日期:2012-07-18 20:41:42
点击:8030
好评:0
关于电镀阳极材料选择
日期:2012-07-18 20:41:42
点击:8030
好评:0
教材18页提出,“在电镀槽中,镀件做阴极,可以用镀层金属做阳极,利用其阳极溶解提供镀层金属,也可以用惰性电极材料做阳极,镀层金属则由电镀液提供;电镀液通常采用含有 镀层金属离子的盐溶液。”这与以前版本要求“阳极必须是镀层金属”有了差异,应该说现在教材的说法是更严密...
 电镀池的规律
日期:2012-05-21 11:01:36
点击:3992
好评:1
电镀池的规律
日期:2012-05-21 11:01:36
点击:3992
好评:1
以镀层金属为阳极,待镀金属制品为阴极,含镀层金属离子的溶液为电镀液。 电镀过程的特点:①牺牲阳极;②电镀液的浓度(严格说是镀层金属离子的浓度)保持不变;③在电镀控制的条件下,水电离产生的H + 、OH - 一般不放电。...
 原电池、电解池、电镀池的判断规律
日期:2012-05-21 10:46:40
点击:4228
好评:0
原电池、电解池、电镀池的判断规律
日期:2012-05-21 10:46:40
点击:4228
好评:0
(1)若无外接电源,又具备组成原电池的三个条件。 ①有活泼性不同的两个电极; ②两极用导线互相连接成直接插入连通的电解质溶液里; ③较活泼金属与电解质溶液能发生氧化还原反应(有时是与水电离产生的H + 作用),只要同时具备这三个条件即为原电池。 (2)若有外...
 实验模拟:电镀装置
日期:2012-05-08 16:51:22
点击:326
好评:0
实验模拟:电镀装置
日期:2012-05-08 16:51:22
点击:326
好评:0
...
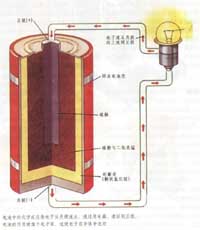 实验模拟:电镀原理
日期:2012-04-24 21:58:11
点击:416
好评:0
实验模拟:电镀原理
日期:2012-04-24 21:58:11
点击:416
好评:0
...
 情景素材-电镀技术
日期:2012-03-27 16:14:14
点击:316
好评:0
情景素材-电镀技术
日期:2012-03-27 16:14:14
点击:316
好评:0
电镀...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。