
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
电子是质量极轻、体积极小、带负电荷的微粒,它在原子这样大小的空间(直径约为10-10m)内做高速运动。它的运动和普通宠观物体不同,它具有自己的特殊规律。
1、电子云的概念
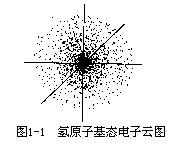
对宏观物体的运动,可以用经典力学来描述。例如火车在轨道上奔驰,人造卫星按一定轨道围绕地球运行,都可以测定或根据一定的数据计算出它们在某一时刻所在的位置和速度,并能描绘出它们的运动轨迹。而在原子核外运动的电子则不同,它不遵循经典力学的规律,必须用20世纪初创立的量子力学理论来描述。现已经证明电子在核外空间所处的位置及其运动速度不能同时准确地确定,也就是不能描绘出它的运动轨迹。在量子力学中采用统计的方法,即对一个电子多次的行为或许多电子的一次行为进行总的研究,可以统计出电子在核外空间某单位体积中出现机会的多少,这个机会在数学上称为概率密度。例如氢原子核外有一个电子,这个电子在核外好像是毫无规则地运动,一会儿在这里出现,一会儿在那里出现,但是对千百万个电子的运动状态统计而言,电子在核外空间的运动是有规律的,在一个球形区域里经常出现,如一团带负电荷的云雾,笼罩在原子核的周围,人们称之为电子云。这团“电子云雾”呈球形对称,如图1-1所示。电子云是电子在核外空间出现概率密度分布的一种形象描述。原子核位于中心,小黑点的密疏表示核外电子概率密度的大小。
2、 四个量子数
量子力学对核外电子运动状态的描述引出四个量子数,即电子的运动状态可以用四个量子数来规定。主量子数n,角量子数l,磁量子数m和自旋量子数ms。其中n,l和m三个量子数确定电子在空间运动的轨道,称为原子轨道。当然电子运动并不是真有确定的轨道,量子力学理论认为电子在整个原子空间都有可能出现,只是在各处出现的概率密度不同,因而运动状态也不同。电子不仅在核外空间不停地运动,而且还做自旋运动,自旋量子数ms规定电子自旋运动状态。所以,电子的运动状态通常由n,l,m三个量子数决定轨道运动,由ms决定自旋运动。这四个量的具体含义和取值大致如下。
主量子数n 它规定了核外电子离核的远近和电子能量的高低。由近及远,由低至高,n可取正整数1,2,3,4…n值越大,表示电子离原子核越远,能量越高。反之,n越小,则电子离核越近,能量越低。由于n只能取正整数,所以电子的能量是分立的不连续的,或者说能量是量子化的。这也相当于把核外电子分为不同的电子层,凡n相同的电子属于同一层。习惯用K,L,M,N,O,P来代表n=1,2,3,4,5,6的电子层。
角量子数l 它描述的是电子在原子核外出现的概率密度随空间角度的变化,即决定原子轨道或电子云的形状。l可取小于n的正整数,即0,1,2,…,n-1,如n=4,l可以是0,1,2,3,相应的符号是s,p,d,f…例如l=0,就用s表示,l=1用p表示等等。对含有多于1个电子的原子(或称多电子原子),当n相同时,l越大,电子的能量越高。因此,常把n相同,l不同的状态称为电子亚层,一个电子层可以分为几个亚层。如n=2(L层),有两个亚层,即l=0和1,相应的原子轨道符号为2s和2p;当n=3(M层)时,有l=0,1,2三个亚层,可分别用 3s,3p和3d表示。以此类推。
磁量子数m 它规定电子运动状态在空间伸展的取向。 m的数值可取0,±1,±2,…,±l。对某个运动状态可有2l+1个伸展方向。s轨道的l=0,所以只有一种取向,它是球对称的。p轨道l=1,m=-1,0,+1,所以有三种取向,用 Px,Py和Pz表示。图1-2为s和p原子轨道轮廓图。s轨道在空间伸展取向呈球对称,而px轨道伸展取向垂直于yZ平面,py取向垂直于xz平面,而Pz取向则垂直于xy平面。
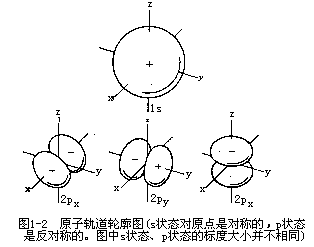
图1-2原子轨道轮廓图(s状态对原点是对称的,p状态是反对称的。图中s状态、p状态的标度大小并不相同)
自旋量子数ms 电子除绕原子核运动外,它本身还做自旋运动。电子
![]()
也常用↑和↓符号表示自旋方向相反的电子。
四个量子数的物理意义及数值之间的相互关系都是量子力学在处理波动方程时求解得到的,并有物理和化学的实验依据,本书不做阐述。这里仅把这些结论作为描述电子运动状态的符号使用。
3、核外电子排布
多电子原子的核外电子排布可用四个量子数描述,它们遵循以下三条原理。
保里不相容原理 在一个原子中没有两个电子具有完全相同的四个量子数。或者说一个原子轨道上最多只能排两个电子,而且这两个电子自旋方向必须相反。因此一个s轨道最多只能有2个电子,p轨道最多可以容纳6个电子。按照这个原理,表1-1归纳了各个原子轨道上可容纳最多的电子数,从表中可得出第n电子层能容纳的电子总数为2n2个。
能量最低原理 自然界一个普遍的规律是“能量越低越稳定”。原子中的电子也是如此。在不违反保里原理的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,这样的状态是原子的基态。
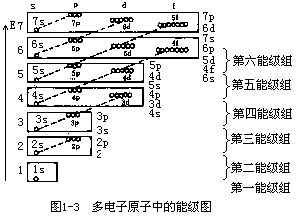
原子轨道能量的高低(也称能级)主要由主量子数n和角量子数l决定。当l相同时,n越大,原子轨道能量E越高,例如E1s<E2s<E3s;E2p<E3p<E4p。当n相同时,l越大,能级也越高,如E3s<E3p<E3d。当n和l都不同时,情况比较复杂,必须同时考虑原子核对电子的吸引及电子之间的相互排斥力。由于其他电子的存在往往减弱了原子核对外层电子的吸引力,从而使多电子原子的能级产生交错现象,如E4s<E3d,E5s<E5s。Pauling根据光谱实验数据以及理论计算结果,提出了多电子原子轨道的近似能级图,如图1-3所示。用小圆圈代表原子轨道,按能量高低顺序排列起来,将轨道能量相近的放在同一个方框中组成一个能级组,共有7个能级组。电子可按这种能级图从低至高顺序填入。
洪特规则在能量相等的轨道上,自旋平行的电子数目最多
时,原子的能量最低。所以在能量相等的轨道上,电子尽可能自旋平行地多占不同的轨道。例如碳原子核外有6个电子,按能量最低原理和保里不相容原理,首先有2个电子排布到第一层的1s轨道中,另外2个电子填入第二层的2s轨道中,剩余2个电子排布在2个p轨道上,具有相同的自旋方向,而不是两个电子集中在一个p轨道,自旋方向相反。
作为洪特规则的补充,能量相等的轨道全充满、半充满或全空的状态比较稳定。
根据以上原则,电子在原子轨道中填充排布的顺序为1s 2s 2p3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d…
下面我们运用核外电子排布的三原则来讨论核外电子排布的几个实例。
氮(N)原子核外有7个电子,根据能量最低原理和保里不相容原理,首先有2个电子排布到第一层的1s轨道中,又有2个电子排布到第二层的2s轨道中。按照洪特规则,余下的3个电子将以相同的自旋方式分别排布到3个方向不同但能量相同的2p轨道中。氮原子的电子排布式为1s22s22p2。这种用量子数n和l表示的电子排布方式,叫做电子构型或电子组态,右上角的数字是轨道中的电子数目。也可以用下式比较形象地表明这些电子的磁量子数和自旋量子数:
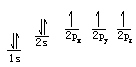
氖(Ne)原子核外有10个电子,根据电子排布三原则,第一电子层中有2个电子排布到1s轨道上,第二层中有8个电子,其中2个排布到2s轨道上,6个排布到2p轨道上。因此氖的原子结构可以用电子构型表示为1s22s22p6。这种最外电子层为8电子的结构,通常是一种比较稳定的结构,称为稀有气体结构。
钠(Na)原子核外有11个电子,按照电子排布顺序,最后一个电子应填充到第三电子层上,它的电子构型为1s22s22p63s1。为了避免电子结构式书写过繁,通常把内层电子已达到稀有气体结构的部分写成“原子实”,以稀有气体的元素符号外加方括号来表示,因此钠原子的电子构型也可以表示为[Ne]3s1。
钾(K)原子核外有19个电子,由于3d和4s轨道能级交错,第19个电子填入4s轨道而不填入3d轨道,其电子构型为1s22s22p63s23p64s1或[Ar]4s1。同理20号元素钙(Ca)的第19,20个电子也填入4s轨道,钙原子的电子构型为[Ar]4s2。
铬(Cr)原子核外有24个电子,最高能级组中有6个电子。铬的电子构型为[Ar]3d54s1,而不是[Ar]3d44s2。这是因为3d5的半充满结构是一种能量较低的稳定结构。
根据核外电子排布原则和光谱实验的结果,可确定原子的核外电子排布。附录1列出了各元素的原子核外的电子构型。
电子排布原理是概括了大量事实后提出的一般规律,因此绝大多数原子的核外电子的实际排布与这些原理给出的结果是一致的;然而有些副族元素,特别是第五、六、七周期的某些元素,实验测定结果并不能用电子排布原理完满地解释。因此,对于某一个具体元素的原子电子排布情况,要以光谱实验的结果为准,原理总是有其相对近似性的,科学的任务是承认矛盾,发展原理,使它更加符合实际。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。多电子原子中,在考虑某个电子时,可以把其他电子对其排斥作用看作削弱了原子核对它的...
1.核外电子共有几个能层? 能层电子层,根据离原子核远近的不同,由里向外可分为第一、二...
1.一个电子的运动状态要从哪几个方面描述? 答:应从这个电子所处的能层(电子层)是第...
...
基态和激发态 什么是光谱? 光谱:不同元素的原子发生跃迁时会 吸收 ( 基态→激发态 ...
鲍林的能级图只是个近似的能级图,是帮助我们理解电子的填充过程。 但电子填充后轨道...