
|
学习小专题 |

|
学习小专题 |
 [物质结构与性质综合] 高中化学物质结构疑难问题15例 作者:化学自习室 来源:未知 日期:2020-12-18 16:40:55 点击:1046 所属专题:物质结构与性质问题集
[物质结构与性质综合] 高中化学物质结构疑难问题15例 作者:化学自习室 来源:未知 日期:2020-12-18 16:40:55 点击:1046 所属专题:物质结构与性质问题集
【问题1】为什么原子核外电子排布时,(n-1)d ns等出现能级交错现象? 【答】由于电子云的形状及特点,s电子云为球形,电子云“重心”更趋近原子中心,而d轧道电子云形状为“∞”,电子云“重心”更趋向离原子中心更远的位置,从而导致(n-1)d ns,其它f轧轧道也如此...
 [物质结构与性质综合] 《物质结构与性质》说理题答题模板 作者:化学自习室 来源:未知 日期:2020-07-11 17:19:22 点击:1862 所属专题:物质结构说理题 答题模板
[物质结构与性质综合] 《物质结构与性质》说理题答题模板 作者:化学自习室 来源:未知 日期:2020-07-11 17:19:22 点击:1862 所属专题:物质结构说理题 答题模板
1、高温陶瓷材料Si 3 N 4 晶体中键角N—Si—N > Si—N—Si(填“>”“<”“=”),原因是: N原子上有孤电子对,由于孤电子对与成键电子对的排斥力更大,使得Si—N—Si键角较...
 [物质结构与性质综合] 《物质结构 元素周期律》常考知识点 作者:化学自习室 来源:未知 日期:2020-03-31 20:01:59 点击:2287 所属专题:物质结构必修
[物质结构与性质综合] 《物质结构 元素周期律》常考知识点 作者:化学自习室 来源:未知 日期:2020-03-31 20:01:59 点击:2287 所属专题:物质结构必修
一、元素金属性、非金属性强弱的判断方法有哪些? 1.元素金属性强弱的判断方法 本质:原子越易失电子,则金属性就越强。 (1)根据元素周期表进行判断: 同一周期:从左到右,随着原子序数的递增,元素的金属性逐渐减弱。 同一主族:从上到下,随着原子序数的递增,元素的金属...
 [物质结构与性质综合] 物质结构中的反常或不一定 作者:胡嘉谋 来源:未知 日期:2020-03-02 17:43:57 点击:983 所属专题:物质结构与性质 反常
[物质结构与性质综合] 物质结构中的反常或不一定 作者:胡嘉谋 来源:未知 日期:2020-03-02 17:43:57 点击:983 所属专题:物质结构与性质 反常
一、原子结构方面 1、原子均有质子、中子、电子构成,但H、H + 、H - 等微粒没有中子。 2、非金属元素一般都在p区,但H元素在s区。 3、主族元素的价电子数=最外层电子数=外围电子数=主族序数=最高正价,但O、F例外。 4、电子排布遵循能量:3d>4s,但失电子顺序则是先失4s...
 [物质结构与性质综合] 物质结构说理题汇总 作者:化学自习室 来源:未知 日期:2020-02-24 14:41:28 点击:2986 所属专题:物质结构说理题
[物质结构与性质综合] 物质结构说理题汇总 作者:化学自习室 来源:未知 日期:2020-02-24 14:41:28 点击:2986 所属专题:物质结构说理题
1 、氮原子间能形成氮氮叁键,而砷原子间不易形成叁键的原因是 砷原子半径较大,原子间形成的 σ 键较长 ,p-p 轨道肩并肩重叠程度较小或几乎不能重叠,难以形成 π 键。 AsH 3 分子为三角锥形,键角为 91.80° ,小于氨分子键角 107°,AsH 3 分子键角较小的原因是 砷原...
 [物质结构与性质综合] 物质结构说理题之原子结构问题 作者:化学自习室 来源:未知 日期:2020-02-24 14:41:53 点击:4791 所属专题:物质结构说理题 原子结构03
[物质结构与性质综合] 物质结构说理题之原子结构问题 作者:化学自习室 来源:未知 日期:2020-02-24 14:41:53 点击:4791 所属专题:物质结构说理题 原子结构03
1、稳定性H 2 S>H 2 Se的原因是: 【答】H键的键能比Se-H键的键能大。 2、焰色反应发生的原因为: 【答】激发态电子向基态跃迁,能量以光的形式释放(发射光谱)。 3、检验K元素的方法是焰色反应,请用原子结构的知识解释产生此现象的原因: 【答】当基态原子的电子吸...
 [物质结构与性质综合] 物质结构说理题之核外电子排布问题 作者:化学自习室 来源:未知 日期:2020-02-24 14:42:19 点击:1651 所属专题:物质结构说理题 核外电子排布
[物质结构与性质综合] 物质结构说理题之核外电子排布问题 作者:化学自习室 来源:未知 日期:2020-02-24 14:42:19 点击:1651 所属专题:物质结构说理题 核外电子排布
1、氧元素的第一电离能小于氮元素,原因是: 【答】氮原子的2p轨道处于较稳定的半充满状态而氧原子的不是,氧原子的原子核对电子的吸引能力弱于氟离子。 2、尿素[CO(NH 2 ) 2 ]分子中N、O元素的第一电离能NO,原因是: 【答】N元素的2P能级为半充满,是较稳定的结构,失...
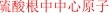 [物质结构与性质综合] 物质结构说理题之键角问题 作者:化学自习室 来源:未知 日期:2020-02-24 14:42:49 点击:4622 所属专题:物质结构说理题 键角
[物质结构与性质综合] 物质结构说理题之键角问题 作者:化学自习室 来源:未知 日期:2020-02-24 14:42:49 点击:4622 所属专题:物质结构说理题 键角
1、CH 4 的键角大于NH 3 的原因为: 【答】CH 4 中都是C-H单键,键与键之间的排斥力一样,所以是正四面体109.5度,而NH 3 有未成键的孤对电子,孤对电子间的排斥力>孤对电子对化学键的排斥力>化学键间的排斥力,所以由于孤对电子的排斥,键角要小于没有孤对电子排斥...
 [物质结构与性质综合] 物质结构说理题之溶解性问题 作者:化学自习室 来源:未知 日期:2020-03-27 13:32:16 点击:1915 所属专题:物质结构说理题 分子溶解性
[物质结构与性质综合] 物质结构说理题之溶解性问题 作者:化学自习室 来源:未知 日期:2020-03-27 13:32:16 点击:1915 所属专题:物质结构说理题 分子溶解性
1、氨气极易溶于水的原因为: 【答】氨气和水都是极性分子,相似相溶;氨气与水分子间能形成氢键。 2、水由液体形成固体后密度却减小,原因为: 【答】水在形成晶体时,由于氢键的作用使分子间距离增大,空间利用率降低,密度减...
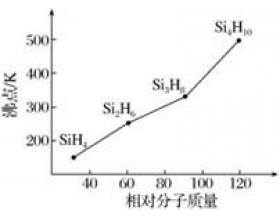 [物质结构与性质综合] 物质结构说理题之熔沸点问题 作者:化学自习室 来源:未知 日期:2020-02-24 14:43:29 点击:4713 所属专题:物质结构说理题 熔沸点
[物质结构与性质综合] 物质结构说理题之熔沸点问题 作者:化学自习室 来源:未知 日期:2020-02-24 14:43:29 点击:4713 所属专题:物质结构说理题 熔沸点
1、氯化铝的熔点为190℃,而氟化铝的熔点为1290℃,导致这种差异的原因为 【答】AlCl 3 是分子晶体,而AlF 3 是离子晶体。 2、P 4 O 10 的沸点明显高于P 4 O 6 ,原因是: 【答】都是分子晶体,P 4 O 10 的分子间作用力高于P 4 O 6 3、H 2 S熔点为-85.5℃,而与其具有...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。...
知识要点 1.电子运动状态的各种特征(以Mn为例,1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 )...
一. 解题要领 解题步骤 解题策略 首尾呼应 找出主线 1. 对照原料和产品,确定核心反应...
一、物质结构常见的表示方法 1. 最简式(实验式): “ 用元素符号表示化合物中各元素...
一、电子的运动状态与电子的空间运动状态不同 电子的运动状态包括空间运动状态和自旋...
01.原子结构 02.核素原子一定含有质子和中子 【错误;反例如氕原子,只含有一个质子,...
注意:阴阳离子的配位数与化学式的关系 例如,CaF 2 晶胞中 晶体 类型(晶胞原型) 晶...
一、电子的运动状态与电子的空间运动状态不同 电子的运动状态包括 空间运动状态 和 自...