
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑d] 元素基态电子排布式 作者:秦文鑫 来源:未知 日期:2013-04-09 10:10:27 点击:18875 所属专题:电子排布式
[注解与辨疑d] 元素基态电子排布式 作者:秦文鑫 来源:未知 日期:2013-04-09 10:10:27 点击:18875 所属专题:电子排布式
原子序数 元素 电子构型 原子序数 元素 电子构型 原子序数 元素 电子构型 1 H 1s 1 38 Sr [Kr]5s 2 75 Re [Xe]4f 14 5d 5 6s 2 2 He 1s 2 39 Y [Kr]4d 1 5s 2 76 Os [Xe]4f 14 5d 6 6s 2 3 Li [He]2s 1 40 Zr [Kr]4d 2 5s 2 77 Ir [Xe]4f 14 5d 7 6s 2 4 Be [He]2s 2 41...
 [注解与辨疑d] 原子最外层、次外层及倒数第三层最多容纳电子数的解释 作者:胡长胜 来源:未知 日期:2018-07-17 13:18:29 点击:12031 所属专题:核外电子排布 最外层电子
[注解与辨疑d] 原子最外层、次外层及倒数第三层最多容纳电子数的解释 作者:胡长胜 来源:未知 日期:2018-07-17 13:18:29 点击:12031 所属专题:核外电子排布 最外层电子
1.依据 构造原理中的排布顺序,其实质是各能级的能量高低顺序,可由公式得出 n s( n -2)f( n -1)d n p。 2.解释 (1)最外层由 n s、 n p组成,电子数不大于2+6=8。 (2)次外层由( n -1)s( n -1)p( n -1)d组成,所容纳的电子数不大于2+6+10=18。 (3)倒数第三层...
 [注解与辨疑d] 为什么原子的基态是稳定的? 作者:王世坤 来源:未知 日期:2016-01-30 12:16:37 点击:3443 所属专题:基态 稳定性
[注解与辨疑d] 为什么原子的基态是稳定的? 作者:王世坤 来源:未知 日期:2016-01-30 12:16:37 点击:3443 所属专题:基态 稳定性
基态原子是指原子的核外电子处于能量最低的原子轨道中运动,这种状态的原子,电子离核的距离最小,受原子核的引力最大,所以基态原子是稳定的。原子中的核外电子是不会被吸入原子核的,这是因为在确定轨道中运动的电子,它的能量不会发生改变,电子运动的离心力和原子核的引力...
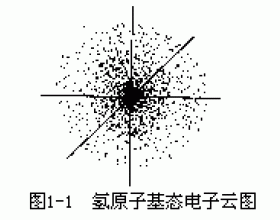 [注解与辨疑d] 核外电子的运动状态 作者:吴键 来源:未知 日期:2021-12-17 09:16:01 点击:38064 所属专题:核外电子运动状态
[注解与辨疑d] 核外电子的运动状态 作者:吴键 来源:未知 日期:2021-12-17 09:16:01 点击:38064 所属专题:核外电子运动状态
电子是质量极轻、体积极...
1.元素的分区和族 1) s 区: , 最后的电子填在 ns 上, 包括 IAIIA, 属于活泼金属, 为碱金属和碱土金属; 2) p区: , 最后的电子填在np上, 包括 IIIA-VIIA以及 0族元素, 为非金属和少数金属; 3) d区: , 最后的电子填在(n-1)d上, 包括 IIIB-VIIB以及VIII族元素, 为过渡金属; ...
1. 排布原则 1) 能量最低原理 电子由能量低的轨道向能量高的轨道排布(电子先填充能量低的轨道,后填充能量高的轨道. 2) Pauli(保利)不相容原理 每个原子轨道中只能容纳两个自旋方向相反的电子(即同一原子中没有运动状态完全相同的电子,亦即无四个量子数完全相同的电子). ...
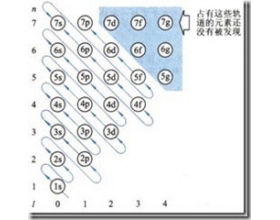 [探讨与扩展a] 为什么Fe变成Fe2+失去的是4s电子? 作者:张楠 来源:未知 日期:2021-12-28 08:49:16 点击:4219 所属专题:铁的失电子
[探讨与扩展a] 为什么Fe变成Fe2+失去的是4s电子? 作者:张楠 来源:未知 日期:2021-12-28 08:49:16 点击:4219 所属专题:铁的失电子
我们在填充电子的时候,使用了一个工具,在选修3将它称为“构造原理示意图”,其实它的准确名称应该是“Pauling近似轨道能级图”,在进行教学时,学生容易“错误”的理解填充的顺序一定是按照能量由高到低进行的。 Pauling近似轨道能级图 其实这一图形之所以是“近似”...
 [注解与辨疑a] 元素的化合价与原子结构的关系 作者:王宗峰 来源:未知 日期:2012-12-03 10:12:39 点击:12306 所属专题:化合价
[注解与辨疑a] 元素的化合价与原子结构的关系 作者:王宗峰 来源:未知 日期:2012-12-03 10:12:39 点击:12306 所属专题:化合价
元素的化合价是一种元素一定数目的原子跟其他元素一定数目的原子化合的性质。元素的化合价和元素的原子结构,特别是最外层电子有密切的关系。 在离子化合物里,元素的化合价的数值就是这种元素的一个原子得失电子的数目。在共价化合物里,元素的化合价的数值就是这种元...
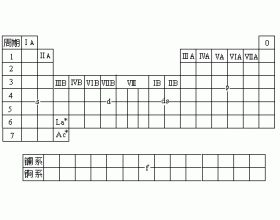 [注解与辨疑d] 周期表中元素分区 作者:陈女婷 来源:未知 日期:2012-11-29 12:56:09 点击:20839 所属专题:元素分区
[注解与辨疑d] 周期表中元素分区 作者:陈女婷 来源:未知 日期:2012-11-29 12:56:09 点击:20839 所属专题:元素分区
根据元素原子的电子层结构特征,可将周期表中元素分为5个区(见下图): ①s区元素 包括ⅠA族碱金属和ⅡA族碱土金属,价电子层结构为ns 1 和ns 2 。这些元素的原子最外层只有1或2个电子,很易失去形成+1或+2价离子,都是活泼的金属元素。 ②p区元素 包括ⅢA族到零族元素...
 [注解与辨疑d] 洪特规则 作者:吴键 来源:未知 日期:2016-01-30 12:23:38 点击:4856 所属专题:洪特规则 构造原理
[注解与辨疑d] 洪特规则 作者:吴键 来源:未知 日期:2016-01-30 12:23:38 点击:4856 所属专题:洪特规则 构造原理
洪特规则 又称等价轨道规则。在同一电子亚层中排布的电子,总是尽先占据不同的轨道,且自旋方向相同。如氮原子中3个p电子分布于3个p轨道上并取向相同的自旋方向。p轨道上有3个电子、d轨道上有5个电子、f轨道上有7个电子时,都是半充满的稳定结构。另外量子力学的研究表...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。多电子原子中,在考虑某个电子时,可以把其他电子对其排斥作用看作削弱了原子核对它的...
1.核外电子共有几个能层? 能层电子层,根据离原子核远近的不同,由里向外可分为第一、二...
1.一个电子的运动状态要从哪几个方面描述? 答:应从这个电子所处的能层(电子层)是第...
...
基态和激发态 什么是光谱? 光谱:不同元素的原子发生跃迁时会 吸收 ( 基态→激发态 ...
鲍林的能级图只是个近似的能级图,是帮助我们理解电子的填充过程。 但电子填充后轨道...
核外电子排布是非常有意思的。在开始的时候,人类发现电子之后不知道电子在原子里面怎...
电子云不是云,是概率分布图 电子云是电子在原子核外空间出现的概率密度分布图。它不...