
|
学习小专题 |
【定义】由一种金属跟另一种或几种金属或非金属所组成的具有金属特性的物质叫合金
【说明】【金属互化物】是金属间化合物的简称。在一定条件下,金属之间相互化合而成的化合物。例如Cu3Al、CuZn3、Cu3SN、Ag3Al、FeZn7等,金属互化物的组成并不固定,可以在一定范围内变动。例如Cu5Zn8中的锌的含量可在59~67%之间变动。大多数金属互化物是以金属键相结合,故组 成元素的化合价无法确定。它是合金的一种,这类合金的传热和导电性能比组分金属低,有的具有很高电阻,通常硬而脆。
【两性氢氧化物】既能跟酸反应,又能跟碱反应,分别生成盐和水的氢氧化物,例如Al(OH)3和Zn(OH)2。两性金属氢氧化物都难溶于水。Al(OH)3 溶于盐酸生成铝盐,溶于NaOH溶液生成偏铝酸盐。
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
氢氧化物的两性是由它既能进行酸式电离,又能进行碱式电离决定的,例如Al(OH)3在水中:
AlO2- +H+ +H2O Al(OH)3
Al(OH)3 Al3+ +3OH-
Al3+ +3OH-
未溶的Al(OH)3与两种电离产生的离子建立动态平衡。当加入盐酸时,平衡向右移动,Al(OH)3继续溶解,发生碱式电离产生OHˉ,与盐酸中和生成AlCl3和H2O;当加入NaOH溶液时,平衡向左移动,Al(OH)3也继续溶解,发生酸式电离产生H+ 与NaOH中和生成NaAlO2和H2O。Al(OH)3是典型的两性氢氧化物,它的酸性和碱性都很弱。
两性氢氧化物表现酸性时,可写成酸的形式,例如H3AlO3、H2ZnO2。一些非金属氢氧化物以酸性为主,一般写酸的形式,例如亚砷酸(H3AsO3)。
【碘酸钾】化学式KIO3,式量214.01。无色、无光泽或乳白色等轴晶体,密度3.89克/厘米3 ,易溶于水而不溶于乙醇,水溶液显中性。熔点560℃(部分分解),温度更高时,分解生成碘化钾和氧气。碘酸钾有强氧化性,是强氧化剂,跟有机物混合经撞击即行爆炸。用做分析试剂、基准试剂、氧化剂、氧化还原滴定剂等。由氯酸钾跟盐酸及碘反应先制成酸式碘酸钾KIO3·HIO3;再使之跟氢氧化钾溶液反应,即可制得。
【碘酸及其盐】
碘酸HIO3比氯酸和溴酸都稳定,是一种白色固体。它受热时分解为I2和O2:
2HIO3![]() I2O5 + H2O
I2O5 + H2O
4HIO3 ![]() 2I2 + 5O2 + 2H2O
2I2 + 5O2 + 2H2O
碘酸是中强酸,它的浓溶液是强氧化剂,但氧化性不如溴酸和氯酸,所以单质碘能从溴酸盐或氯酸盐的酸性溶液中置换出单质溴和氯:
2BrO3- + 2H+ + I2![]() 2HIO3 + Br2
2HIO3 + Br2
2ClO3- + 2H+ + I2![]() 2HIO3 + Cl2
2HIO3 + Cl2
在酸性介质中,碘酸盐能氧化碘离子生成单质碘:
IO3- + 5I- + 6H+ ![]() 3I2 + 3H2O
3I2 + 3H2O
【氯化铝】化学式AlCl3,式量133.34。无色透明晶体或白色而微带浅黄色的结晶性粉末。密度2.44克/厘米3,熔点190℃(2.5大气压),在常压下177.8℃升华,沸点182.7℃。氯化铝的蒸气或溶于非极性溶剂中或处于熔融状态时,都以共价的二聚分子Al2Cl6形式存在。在空气中极易吸收水分并部分水解放出氯化氢而形成酸雾。易溶于水并强烈水解,溶液显酸性。也溶于乙醇和乙醚,同时放出大量的热。六水合氯化铝为无色斜方晶体,密度 2.398克/厘米3,100℃时分解。用做有机合成和石油工业的催化剂、染料的中间体,还用于处理润滑油,制造葸醌、丁基橡胶和烃类树脂。金属铝跟氯气反应或无水氯化氢跟熔融铝反应均可制得。
银白色有光泽金属,质轻,有良好的延展性和传热导电性,熔点660.5℃,沸点2467℃,硬度2~2.9,密度2.7克/厘米3。丰度(质量%)8.05%,在地壳中居第三位。
铝是化学性质较活泼的金属。常温下在空气中金属表面发生缓慢氧化生成一薄层致密氧化物膜,阻止氧气、水继续跟铝反应,但可透过光线,这层膜对铝起保护作用,因此铝有一定抗锈蚀能力。若去掉这层氧化膜,并使铝跟汞形成铝汞齐,则很易被空气中氧气氧化,也能跟水剧烈反应放出氢气生成氢氧化铝。铝在加热时可在氧气中燃烧生成氧化铝发强白光并放出大量的热。由于铝跟氧有较强的亲合力,因此铝有强还原性,冶金工业上用做还原剂,冶炼高熔点金属如镍、铬、锰、钒等,铝粉跟上述金属氧化物粉末的混合物叫铝热剂。用铝还原金属的方法,称为铝热还原法。铝也用做炼钢中的脱氧剂。加热时铝可跟卤素、氮气、磷、硫、碳等化合。高纯铝不跟一般酸反应,只溶于王水。一般铝可溶于盐酸、稀硫酸并放出氢气。常温时在浓硫酸或浓硝酸中发生钝化,因此,可用铝容器储运这些浓酸。铝可跟热硫酸反应放出二氧化硫:
铝可溶于强碱溶液中生成偏铝酸盐并放出氢气。
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
纯铝可用于制电线、电缆。铝大量用于制合金、电器设备、建筑设备、机械、化工设备:汽车、飞机、宇航飞行器、日用器皿等。铝粉(俗称“银粉”)用于配制油漆、烟火等。铝在自然界主要以铝硅酸盐的形式存在,如长石、云母、高岭土等。铝矿石主要有铝土矿(Al2O3·nH2O)和冰晶石(Na3AlF6)。1827年德国化学家维勒把无水氯化铝跟钾放在铂坩埚里密闭加热得到粉末状铝。工业上用电解氧化铝跟冰晶石的熔融混合物制得铝。
【萤石】主要成分是氟化钙CaF2,又称氟石。含氟的主要矿石。因有显著的萤光现象而得名。常呈立方体、八面体、菱形十二面体等不同晶体,萤石为致密的块状矿石。因含不同的杂质而呈无色、灰色、黄色、绿色、紫色等。透明,有玻璃光泽,质脆,密度3.01~3.25克/厘米3,硬度4.0。难溶于水,跟硫酸反应,放出氟化氢。萤石在冶金工业上用作助熔剂,化学工业用它制氟、氟化氢和其它氟化物,硅酸盐工业用它制乳浊玻璃和搪瓷等,无色透明的萤石可制光学仪器中的棱镜和透光镜。
【概述】化学式HClO4,式量100.46,最高价氯的含氧酸。无色粘稠液体,密度1.76克/厘米3,熔点-112℃,沸点39℃(7459帕——56毫米汞柱)。易吸湿,溶于水,常用试剂浓度为70%。纯态不稳定。已知最强酸,能与活泼金属反应放出氢气,与氨反应生成铵盐。有强氧化性,遇有机物发生爆炸性反应,同HI或SOCl2反应时会燃烧。纯酸加热至90℃分解为ClO2及O2。冷的稀溶液稳定性高。不显氧化性。有腐蚀性。用于制炸药、医药、分析化学。用高氯酸钾同浓硫酸反应后,再经减压蒸馏制得。工业上用铂电极电解氧化盐酸制得。
【性质】
高氯酸是已知酸中最强的酸,但它的氧化性在冷的稀溶液中很弱,浓溶液则有较强的氧化性。当热的浓酸与易燃物质接触则会发生猛烈爆炸。在钢铁分析中常用HClO4溶解矿样。
在溶液中,ClO4- 离子非常稳定,如SO2、H2S、Zn、Al等较强的还原剂都不能使它还原。当溶液酸化后,ClO4- 的氧化性增强。ClO4- 离子对金属离子的结合作用很弱,因此研究溶液中的络合物时加入高氯酸盐,可使溶液保持一定的离子强度。
固态高氯酸盐在高温下是一个强氧化剂,但其氧化能力比氯酸盐弱。用KClO4制作的炸药比用KClO3为原料的炸药稳定些。KClO4在883K时熔化,同时开始依下式分解:
KClO4![]() KCl + 2O2
KCl + 2O2
高氯酸盐一般是可溶的,但Cs+ 、Rb+ 、K+ 及NH4+ 的高氯酸盐的溶解度都很小。
 |
| 高氯酸 |
【概述】化学式HF,式量20.01。即氟化氢的水溶液。无色有刺激性气味。有强烈腐蚀性和毒性。浓度不高时酸性弱(室温下K=3.5×10-4 ),这是因为分子间易形成氢键,难电离出氢离子。浓溶液(5~15摩尔/升)酸性增强变成强酸,因为一部分F- 通过氢键与HF形成缔合离子,如:

消耗了溶液中的F- ,而使HF的电离度增大。能跟二氧化硅或硅酸盐反应生易挥发的SiF4,故易于腐蚀石英、玻璃及其它含硅物质。市售氢氟酸含氟化氢50%。用于制备高纯氟化物,刻蚀玻璃、镀件表面处理、酸洗铜、黄铜、不锈钢等。用水吸收氟化氢制得。
【性质】
氢氟酸是一弱酸(298K时,Ka=3.5×10-4 )。与其它弱酸相同,浓度越稀,HF电离度越大。但溶液浓度增大时,HF2- 离子增多。因为在氢氟酸溶液尤其是浓溶液中,一部分F- 离子通过氢键与未离解的HF分子形成缔合离子,如HF2- 、H2F3- 、H3F4- 等,其中HF2- 离子特别稳定。
HF + F- ![]() HF2- K=5.1
HF2- K=5.1
稀溶液: HF + H2O![]() H3O+ + F- Ka=3.5×10-4
H3O+ + F- Ka=3.5×10-4
浓溶液: 2HF + H2O![]() H3O+ + + HF2-
H3O+ + + HF2-
HF2- 离子是一弱碱,比水合F- 离子稳定,使上式平衡向右移动从而使氢氟酸的电高度增大。当浓度大干5mol·L-1 时,氢氟酸已经是相当强的酸。用碱中和氢氟酸溶液能生成酸式盐如KHF2也说明HF2- 离子的稳定性。
氢氟酸的另一个特殊性质是它能与二氧化硅或硅酸盐反应生成气态SiF4。
SiO2+4HF![]() SiF4+2H2O
SiF4+2H2O
CaSiO3+6HF![]() CaF2+SiF4+3H2O
CaF2+SiF4+3H2O
液态氟化氢有微弱的自偶电离:
2HF![]() H2F+ + F- K≈10-10
H2F+ + F- K≈10-10
它的介电常数(84)和水(81)相仿,是一种有用的溶剂,能溶解很多无机物和有机物。
【氟】元素符号F,原子序数9,原子量18.99。外围电子排布2s2 2p5 ,主要氧化数-1,0。位于第二周期第ⅦA族。原子半径64皮米,F-半径133皮米,第一电离能1682千焦/摩尔,电负4.0。
单质氟由双原子分子F2组成。淡黄色气体,有令人不快的气味。密度1.696克/升(标准状况),熔点-219.6℃,沸点-188.14℃。离解能154.8千焦/摩尔。
氟是电负性最大,非金属性、氧化性最强的元素,化学性质非常活泼。有毒。能跟绝大多数元素化合生成二元氟化物,放出大量热,发生燃烧。跟铝、镍、镁、铜反应时常形成致密的氟化物保护膜。跟水发生剧烈反应,生成物主要有氟化氢和氧气,以及少量的过氧化氢、二氟化氧和臭氧。可从化合物中置换其它非金属元素,如氟气可从固态卤化物中置换出氯、溴、碘。与稀碱溶液反应放出OF2 ,2F2+2NaOH=2NaF+OF2↑+H2O
在加压、加热条件下氟能跟氙直接化合,生成二氟化氙、四氟化氙和六氟化氙。大量氟用来氟化有机物,如氟里昂—12 CCl2F2广泛用作致冷剂,CBr2F2用作高效灭火剂,CCl3F用作杀虫剂。称为特氟隆的聚四氟乙烯具有高弹性、低介电常数、低摩擦系数、耐热抗腐蚀等优良性能,用于制电工、化工器材。原子能工业制UF6,用扩散法分离出235 U。
1886年法国的莫瓦桑,在铂制U形管中,以铂铱合金作电极,电解氟氢化钾的无水氟化氢熔液得到氟。氟在地壳中的丰度为0.066%,主要以化合态存在,主要矿物有萤石CaF2,冰晶石Na3AlF6和磷灰石Ca5F(PO4)3。工业上以石墨和铁作电极,电解熔融的氟氢化钾和氟化氢的混和物制得。

【概述】化学式HF,式量20.01。无色有刺激臭味气体或液体,极性分子,由于很强的氢键作用,常温下气体呈(HF)n(n=2~6)的缔合形式存在,80℃以上才基本由HF组成。液态时可能以比较稳定的五分子环(HF)5或六分子环(HF)6状态存在。气体密度0.991克/升,液体密度0.987克/厘米3,沸点19.54℃,熔点-83.1℃,有很强的腐蚀性和毒性。在空气中易形成白色酸雾,易溶于水,水溶液叫氢氟酸,酸性较弱。能溶于乙醇。能腐蚀玻璃。氟化氢是一个介电常数大的液体,能自行电离,并能与许多溶质形成导电溶液,可溶解许多有机化合物。无水液态氟化氢是一种很强的酸。应保存在塑料容器中。用于制氟化物、氢氟酸、氟硼酸、氟硅酸、有机氟碳化合物,含氟冷冻剂、含氟树脂,还用作半导体材料的清洗剂,蚀刻玻璃等。用浓硫酸跟氟化钙反应制得。
【结构】
氟化氢是极性分子,在293K时能无限制地溶于水中,原因是它同水形成氢键。氟化氢的水溶液称为氢氟酸。
氟化氢的熔点、沸点和气化热特别高是因为其分子间存在氢键的缘故。实验证明,氟化氢在气态、液态和固态时都通过氢键形成不同程度的缔合。在360K以上它的蒸气密度相当于HF,在299K时相当于(HF)2和(HF)3的混合物。在固态时,氟化氢由无限长的锯齿形长链组成。
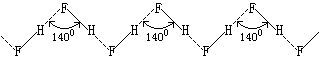
【性质】【氢氟酸】
氢氟酸是一弱酸(298K时,Ka=3.5×10-4 )。与其它弱酸相同,浓度越稀,HF电离度越大。但溶液浓度增大时,HF2- 离子增多。因为在氢氟酸溶液尤其是浓溶液中,一部分F- 离子通过氢键与未离解的HF分子形成缔合离子,如HF2- 、H2F3- 、H3F4- 等,其中HF2- 离子特别稳定。
HF + F- ![]() HF2- K=5.1
HF2- K=5.1
稀溶液: HF + H2O![]() H3O+ + F- Ka=3.5×10-4
H3O+ + F- Ka=3.5×10-4
浓溶液: 2HF + H2O![]() H3O+ + HF2-
H3O+ + HF2-
HF2- 离子是一弱碱,比水合F- 离子稳定,使上式平衡向右移动从而使氢氟酸的电高度增大。当浓度大干5mol·L-1 时,氢氟酸已经是相当强的酸。用碱中和氢氟酸溶液能生成酸式盐如KHF2也说明HF2- 离子的稳定性。
氢氟酸的另一个特殊性质是它能与二氧化硅或硅酸盐反应生成气态SiF4。
SiO2+4HF![]() SiF4+2H2O
SiF4+2H2O
CaSiO3+6HF![]() CaF2+SiF4+3H2O
CaF2+SiF4+3H2O
液态氟化氢有微弱的自偶电离:
2HF![]() H2F+ + F- K≈10-10
H2F+ + F- K≈10-10
它的介电常数(84)和水(81)相仿,是一种有用的溶剂,能溶解很多无机物和有机物。
【二氧化氯】又名过氧化氯,Cl原子以sp3杂化轨道形成σ键,分子V(形分子),相对分子量67.46,密度为3.09(11℃),熔点(℃):-59,沸点(℃):11,红黄色气体。溶于水,同时分解。溶于碱溶液而生成亚氯酸盐和氯酸盐。用作氧化剂、脱臭剂、漂白剂等。由氯酸钠与硫酸和甲醇作用或由氯酸钠与二氧化硫作用而制得。化学性质不稳定,有强的氧化性,会发生爆炸。
二氧化氯诞生于1911年。早年人们并未用它杀菌消毒,直到1940年前后次氯酸钠工业化生产之后,人们才开始大规模使用。1940年美国的尼亚加拉大瀑布率先采用它处理饮用水,取得良好效果,之后迅速推广到全世界。近年来,人们陆续发现用氯气对饮用水进行消毒时,水中的有机物会与氯气发生取代反应,生成有机氯化合物,有机氯会在人体内积留产生慢性累积中毒,还会诱发癌病,世界环保联盟即将全面禁止使用氯气用于饮用水的消毒,建议采用广普性、具有强氧化性的高效消毒剂二氧化氯进行饮用水的消毒。目前,二氧化氯已被联合国卫生组织(WHo)列为AⅠ级消毒剂。
我国应用二氧化氯消毒技术始于八十年代。1987年,广东省卫生监督部门批准其可以用于食品消毒、保鲜及食品设备、用具消毒。1990年上海卫生管理部门批准其可以用于水处理、食品加工以及水产养殖、除臭等。我国卫生部也在2000年前明确提出,逐步用二氧化氯替代氯气进行饮用水的消毒。最近,二氧化氯又被列为预防非典的重要的含氯消毒剂。
二氧化氯是一种极易爆炸的强氧化性气体,在生产和使用时必须尽量用稀有元素气体进行稀释,同时需要避免光照、震动或加热。因此,二氧化氯的制备方法一直科学家长期寻求解决的问题。目前,世界常用的二氧化氯制备方法主要集中为三种。
⑴氯酸钠与浓盐酸反应法
目前,欧洲一些国家主要采用氯酸钠(NaClO3)氧化浓盐酸的制备方法,化学反应方程式为:2NaClO3+4HCl(浓)=2NaCl+Cl2↑+ClO2↑+2H2O。此法的缺点主要是同时产生了大量的氯气,不仅产率低,而且产品难以分离,同时很有可能造成环境污染。
⑵亚氯酸钠与氯气反应法
我国的科学家经过科学探索,发现一种优于欧洲的制备方法,将经干燥空气稀释的氯气通入填充有固体亚氯酸钠(NaClO2)的反应柱内制得。化学反应方程式为:2NaClO2+Cl2=2NaCl+2ClO2↑。此法的特点是安全性好,没有产生毒副产品。
⑶草酸钠还原法
最近,科学家又研究出了一种新的制备方法,在酸性溶液中用草酸钠还原氯酸钠,化学反应方程式为:Na2C2O4+2NaClO3+2H2SO4=Na2SO4+2CO2↑+2ClO2↑+2H2O。此法的最大特点是由于反应过程中生成的二氧化碳的稀释作用,大大提高了生产及储存、运输的安全性。
二氧化氯因为其具有杀菌能力强,对人体及动物没有危害以及对环境不造成二次污染等特点而备受人们的青睐。二氧化氯不仅是一种不产生致癌物的广谱环保型杀菌消毒剂,而且还在杀菌、食品保鲜、除臭等方面表现出显著的效果。
【物理性质】①颜色\气味\状态:通常情况下为有刺激性气味的黄绿色的气体,剧毒。②密度:比空气密度大,密度为3.170g/L③易液化。熔沸点较低,压强为101kPa、温度为-34.6℃时易液化。液态氯为金黄色。如果将温度继续冷却到-101℃时,液氯变成固态氯。④溶解性:易溶于有机溶剂,难溶于饱和食盐水。1体积水在常温下可溶解2体积氯气,形成氯水。
【化学性质】强非金属、强氧化剂。除O2、N2、C和稀有气体外,氯气与其它元素几乎都能直接化合为氯化物,且常将变价元素氧化为高或较高价态,如与Cu、Fe等反应。能与许多还原性化合物反应将其中低价态元素氧化,如与NaBr、 NaI、Na2S反应置换出Br2、I2、S;与NH3反应氧化出N2。与水或碱发生歧化反应,产物为Cl-和氯的含氧酸根ClO-、ClO3-等。如与水的反应:Cl2+H2O HCl+HClO,HClO的强氧化性使氯水和湿氯气有漂白性。与冷的碱溶液反应以生成氯化物和次氯酸盐为主,在热的碱溶液中则有氯酸盐生成。氯气与有机物的反应主要是取代反应,(如对烷、环烷、苯等)、加成反应(如对烯、炔、橡胶和紫外光条件下对苯等)。氯水的有关反应则为:与碱反应同氯气;对H2S,则稀氯水以氧化出硫沉淀为主,浓氯水与H2S反应看不到沉淀而直接氧化出H2SO4;对SO2或SO32-,则生成H2SO4或硫酸盐;对Mg则氯水中的HCl起重要作用有H2放出;与AgNO3溶液也属于其中Cl?的反应,生成白色的AgCl沉淀。若要从氯水获得较浓的HClO溶液,则可加入CaCO3粉,因H2CO3比盐酸弱又比HClO强,而CaCO3只与盐酸反应,使氯水中的化学平衡向生成HClO的方向移动。氯水的漂白性、见光分解出O2以及使醛溶液等氧化皆与其中的HClO有关。
HCl+HClO,HClO的强氧化性使氯水和湿氯气有漂白性。与冷的碱溶液反应以生成氯化物和次氯酸盐为主,在热的碱溶液中则有氯酸盐生成。氯气与有机物的反应主要是取代反应,(如对烷、环烷、苯等)、加成反应(如对烯、炔、橡胶和紫外光条件下对苯等)。氯水的有关反应则为:与碱反应同氯气;对H2S,则稀氯水以氧化出硫沉淀为主,浓氯水与H2S反应看不到沉淀而直接氧化出H2SO4;对SO2或SO32-,则生成H2SO4或硫酸盐;对Mg则氯水中的HCl起重要作用有H2放出;与AgNO3溶液也属于其中Cl?的反应,生成白色的AgCl沉淀。若要从氯水获得较浓的HClO溶液,则可加入CaCO3粉,因H2CO3比盐酸弱又比HClO强,而CaCO3只与盐酸反应,使氯水中的化学平衡向生成HClO的方向移动。氯水的漂白性、见光分解出O2以及使醛溶液等氧化皆与其中的HClO有关。
【氯气的用途】重要化工原料。大量用于制造有机合成的中间体(如氯苯、氯化萘等)、溶剂(如氯代烷类)、盐酸、漂白粉以及制造药物(如氯胺T等)和农药;在生产塑料聚氯乙烯、合成纤维氯纶、合成橡胶氯丁橡胶等合成材料时也需用多量氯气。氯气液化后压入钢瓶常供纸浆漂白、纺织品漂白、自来水消毒杀菌、制次氯酸钠、从卤水中提炼溴和碘以及某些金属或硅的的提纯冶炼等。
【溴化银】AgBr,浅黄色晶体。熔点432℃,加热高于1300℃时分解。难溶于水和稀硝酸,可溶于氨水,饱和NaCl或NaBr溶液、Na2S2O3或KCN溶液。易见光分解,用于制照像底片,感光纸等。在眼镜玻璃中掺入AgBr微粒,在光照时分解出银粒变深,无光时Ag与周围的Br2化合为AgBr又变浅,这是变色镜的变色原理。工业上用AgNO3溶液与NaBr溶液在暗室或红光下反应制取。
 |
| 溴化银 |
【碘化银】AgI,黄色晶体。密度黄色5.683克/厘米3,橙色6.010克/厘米3。难溶于水、氨水或稀硝酸,但溶于Na2S2O3、KCN、KI等水溶液。见光变色,最后变黑,感光作用比AgBr差。用于制照像底片和感光纸,也用于人工降雨。可用AgNO3溶液与KI溶液在红光或暗室中反应制取。若把AgI从AgBr、AgI的混合物中分离出来,可加浓氨水将AgBr、AgCl溶出(生成可溶性Ag(NH3)2+而留下AgI。
【卤族元素】元素周期表中ⅦA族元素,简称卤素。包括氟、氯、溴、碘、砹五种元素。最外层电子数皆为7(具ns2np5结构),易得电子成-1价阴离子。非金属性皆强于同周期的其它元素。除氟为-1价外,其它卤元素皆有-1、+1、+3、+5、+7价。其单质化学性质活泼,能与大多数金属和非金属直接化合,因与金属直接化合成盐,按“天生曰卤,人造曰盐”而得名“卤素”。其中砹为放射性元素。本族在自然界中无游离态,以化合态存在于卤化物和其它矿物中。
卤素单质具化学活泼性,最活泼的是氟,与水猛烈反应出O2,在加热的条件下,绝大多数金属能在氟中燃烧;也易从固态金属卤化物中置换出其它卤素,与H2在低温下发生爆炸式化合。氯活泼性比氟小些。与水反应缓慢生成HCl、HClO,与H2在光照下发生爆炸反应;与多数非金属(除稀有气体、C、O2等)化合成共价化合物,与饱和烃发生取代,与不饱和烃作用发生加成反应,与多数金属反应,大部分有燃烧现象。溴与氯相似,但活泼性比氯稍弱,与H2、金属、非金属反应没有氯那样猛烈,与水反应的程度比氯小,在日光中HBrO也分解出O2。碘的活泼性比溴弱,也发生上述反应,与水几乎不发生化学反应,可氧化S2-,遇淀粉变蓝(55℃以下)。
 |
| 卤素 |
【氯化钙】CaCl2·6H2O,无色六角晶体,熔点29.92℃或30℃,苦咸,易吸湿潮解。加热至200℃失水而成白色立方晶体无水CaCl2,熔点782℃,有强吸湿性。是实验室里常用的干燥剂,但不能用于干燥氨气或洒精蒸气,因为会生成氨合物或酒精合物。保存时必须密闭以防吸水潮解。其水溶液的冰点降低,可用做防冻剂和冷冻液。水溶液里通入CO2、H2S皆不反应,无沉淀现象;若加纯碱则在即有白色沉淀CaCO3析出。遇NaOH溶液,浓时有微溶物Ca(OH)2白色浑浊,如碱液很稀无沉淀现象。
 |
| 氯化钙 |
【氟化钠】NaF,无色或半透明光亮晶体。密度2.558克/厘米3,熔点993℃,沸点1695℃。溶于水,水解呈弱碱性:F-+H2O HF+OH-在玻璃试剂瓶中若有水蒸气则水解出的少量HF会腐蚀玻璃而“发毛”,一般要干燥保存或于塑料瓶内存放。用于杀灭地下害虫、杀菌、木材防腐、焊剂。极少量用于缺氟的饮用水氟化处理和制氟化钠牙膏。可用HF与NaOH或Na2CO3反应制取。
HF+OH-在玻璃试剂瓶中若有水蒸气则水解出的少量HF会腐蚀玻璃而“发毛”,一般要干燥保存或于塑料瓶内存放。用于杀灭地下害虫、杀菌、木材防腐、焊剂。极少量用于缺氟的饮用水氟化处理和制氟化钠牙膏。可用HF与NaOH或Na2CO3反应制取。
【氯化氢】
性质:无色有刺激性气味的气体。标准状态下密度为1.00045克/升,熔点-114.80℃,沸点-85℃。在空气中发白雾,溶于乙醇、乙醚,极易溶于水。实验室中用水吸收时不得把导管口伸入水下,而要在导管口连接倒放的漏斗,使其边缘紧贴水面以利吸收并防止倒吸。因HCl的沸点低,不易液化,若混入少量氯气可用活性炭吸附掉易液化的Cl2。若Cl2中混入HCl则可用少量水或饱和食盐水洗气以除去溶解度甚大的HCl。干燥HCl气不活泼,对锌、铁均无反应。其水溶液叫盐酸,常用的浓盐酸密度为L.18~L.19克/厘米3(含HCl36~38%的溶液)相当于12摩/升左右。浓盐酸是挥发性强酸,加热蒸发时则HCl逸出得比水多,致使浓度下降,至20%即不再下降,成为“恒沸点溶液”。盐酸具有酸的通性,其酸根Cl-无氧化性,为非氧化性酸。
实验室制法:实验室里制取氯化氢是利用食盐和浓硫酸在不加热或稍微加热的条件下进行反应。化学方程式是:
NaCl+H2SO4(浓) NaHSO4+HCl↑
NaHSO4+HCl↑
这个反应是属于固体粉末与液体反应制取气体的类型,所用制气装置与实验室制取氯气的一样。氯化氢极易溶于水,密度比空气大,只能用向上排空气法进行收集。氯化氢有很强的刺激性气味,收集氯化氢后的剩余尾气,不能逸散在室内,可用水进行吸收。

【氟化银】在常温下为白色晶体,熔点为708K,在标况下(20摄氏度,298K,101KPa)溶解度为1800g/L,合约14.17mol/L,极易溶于水.其中Ag-F键长246PM,小于其它卤化银.共价半径为246PM,与Ag-F键长相同,应区别于其它卤化银。键型为离子键,也与其它卤化银相异.晶格类型类似于氯化钠,与氯化银/溴化银相同(碘化银晶格类型类似于硫化锌.)(其它卤化银均有共价键倾向:氯化银/溴化银的键型为过渡键,碘化银键型为共价键),由于AgF易溶,可将Ag2O溶于氢氟酸中制取:Ag2O+2HF===2AgF+H2O,需要注意的是,长期大量接触氟化银者可能导致慢性氟中毒,吞咽氟化银者可导致急性氟中毒而死。
 |
| 氟化银 |
【物理性质】
氟是最活泼的非金属元素,氟单质是目前已知的最强的氧化剂,所以自然界中只有氟的化合物存在。单质氟在常温下是淡黄色气体,剧毒,熔点为53.38K,沸点84.86K,密度1.11g/cm3 。遇水猛烈反应,放出氧气。
氟对于维持正常的生长是必需的。机体摄入的氟过少,可能引起龋齿,过多则可能导致氟骨病和斑釉齿。
【化学性质】
(1)与金属,非金属的作用
氟能与所有金属和非金属(除氮、氧和一些希有气体外)包括氢直接化合,而且反应常常是很猛烈的,伴随着燃烧和爆炸。氟与单质的反应总是得到最高氧化态的氟化物。在室温或不太高温度下,氟与镁、铁、铜、铅、镍等金属反应,在金属表面形成一层保护性的金属氟化物薄膜,可阻止氟与金属进一步的反应。在室温时氟与金、铂不作用,加热时则生成氟化物。
(2)与水、碱的反应
氟不溶于水,但与水剧烈反应放出氧气:
2F2+ 2H2O![]() 4HF + O2
4HF + O2
氟与碱的反应和其它卤素不同,其反应如下:
2F2+ 2OH- (2%)![]() 2F- + OF2+H2O
2F- + OF2+H2O
当碱溶液较浓时,则OF2被分解放出O2。
2F2+ 4OH- ![]() 4F- + O2+2H2O
4F- + O2+2H2O
【用途】
由于F-F键很弱,原子氟是一种高度放热的氧化剂,液态氟可用作火箭,导弹和发射人造卫星的高能燃料。它在原子能工业中用作原子反应堆核燃料235 U的提取235 U仅占天然U的0.75%,利用F2将UF4氧化成UF6(UF6是铀的化合物中仅具有挥发性的),然后用气体扩散法使235 UF6和238 UF6两种化合物分离。大量氟用于制备氟的有机化合物.
氟是人体必需的痕量元素,是形成强硬的骨骼和预防龋齿所必需的元素。人体所需的氟主要来源于饮用水。人饮用水的含氟量以0.5~1.0mg/dm3 比较适宜,小于此值时,龋齿病发病率高达70%~90%。饮用水中含氟量超过4mg/dm3 时,人易患氟骨病,骨骼畸形,严重威胁人体健康。目前对氟骨病尚没有特效疗法,主要办法是降低饮用水中的含氟量。煮沸是一种最简单易行的去氟方法。氟离子常加入牙膏中能防止儿童蛀牙。
【灰口铁】生铁中的一种。含碳量约3%,含硅约2%。灰口铁中碳以片状石墨状态存在。断面呈深灰色。质较软,可进行切削加工。热时容易流动,铸造性能好。较耐磨。强度及延展性差。主要用于铸造。
 |
| 灰口铁 |
【白口铁】生铁中的一种。含碳量约2.5%,硅在1%以下。白口铁中的碳以碳化铁Fe3C存在。断面呈白色,质硬且脆,不易进行机械加工。主要用炼钢。
 |
| 白口铁 |
【生铁】 铁碳合金。一般把含碳量在2~4.3%的铁碳合金叫做生铁。在高炉冶炼过程中,常将铁矿石和焦炭中的硫、磷、硅等带入生铁内。因而使生铁有脆性。生铁产量的90%用于炼钢,10%用于铸造。
【生铁冶炼】
生铁主要是用高炉冶炼的。生铁是铁元素与碳元素的合金,熔点1100~1200℃,含碳量一般为1.7~4.3%,此外尚有少量硅、锰、硫、磷等杂质。熔化的生铁流动性好,适宜铸造,但质硬而脆,不便轧制和焊接。经过熔化冶炼后,含碳量低于1.7%的铁碳合金,叫做钢,具有韧性,易于压力加工。未加熔化炼制的,含碳更低、含杂质较多的就是熟铁。高炉炼铁的任务是把铁矿石炼成生铁。铁矿石在高炉中经过还原作用(排除氧化铁中的氧)、造渣作用(将铁与杂石分开)、渗碳作用(铁吸收碳素)等一系列复杂变化,形成铁水和炉渣。铁水可以直接用来炼钢或铸成铁锭(或铸件);炉渣可以作为水泥、渣砖等的原料。从高炉炉顶放出的高炉煤气(主要含一氧化碳、二氧化碳和氮气、灰尘和某些有害气体)经过净化处理,可作为气体燃料。
炼铁的主要原料是铁矿石(含铁低于45%的矿石,须经过选矿和烧结,才能入高炉冶炼)、焦炭(固定碳含量在80~90%,灰分一般在10~20%,且须强度好)、石灰石(氧化钙含量高,二氧化硅及氧化铝含量低,硫磷含量低,块度适宜)和空气(经过热风炉变成热风再鼓入高炉内,见图)。高炉内的化学反应,自下(炉腹部位)而上(经过炉腰到炉身)主要是:

C+O2 CO
CO
CO2+C 2CO
2CO
Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
CaCO3 CaO+CO2↑
CaO+CO2↑
CaO+SiO2 CaSiO3
CaSiO3
在冶炼过程中,混在铁矿石里的锰、硅、硫、磷等元素也会被还原出来。少量的碳、锰、硅、硫、磷等在高温下熔合在铁里,成为生铁。
【铁锈】铁和铁基合金在含有二氧化碳的潮湿空气中受腐蚀生成的红褐色疏松多孔物质。是一种成分不定的混和物,主要成分有氧化铁、水合氧化铁(Fe2O3·xH2O)、水合氧化亚铁等。不溶于水,可溶于酸。
【氢氧化亚铁】 化学式Fe(OH)2,式量89.866。白色固体,难溶于水。密度3.4克/厘米3。受热易分解。溶于酸,不溶于碱。易被氧化。用碱溶液跟亚铁盐溶液反应可制得。但不易制得纯物,因Fe(OH)2在空气中迅速被氧化,变成灰绿色最后变成棕红色的Fe(OH)3。
 |
| 氢氧化亚铁制备 |
【氢氧化铁】化学式Fe(OH)3,式量106.87。红棕色无定形粉末,密度3.44~3.6克/厘米3。不溶于水。加热时分解成氧化铁和水。略具两性,碱性强于酸性。新制的易溶于酸,稍加放置后则难溶。新制的能溶于强碱溶液生成铁酸盐。用作颜料、药物和砷的解毒剂。由铁盐溶液跟氨水反应制得。
【氧化铁】通常指三氧化二铁,化学式Fe2O3,式量159.69,棕红色粉末,俗称铁红。密度5.24克/厘米3,熔点1565℃。不溶于水,不与水反应。跟酸反应,生成铁盐。在高温下可被氢气、一氧化碳等还原成铁。用作颜料、抛光剂、催化剂等。灼烧硫酸亚铁或氢氧化铁制得。
【四氧化三铁】化学式Fe3O4,式量231.54。铁在四氧化三铁中有两种化合价,经研究证明了Fe3O4是一种铁(Ⅲ)酸盐,即FeⅡFeⅢ[FeⅢO4]。黑色晶体,密度5.18克/厘米3。有磁性,故又称磁性氧化铁。潮湿状态的四氧化三铁在空气中容易氧化成三氧化二铁。不溶于水,溶于酸。用作颜料和抛光剂。磁性氧化铁用于制录音磁带和电讯器材。用红热铁跟水蒸气反应制得。
 |
| 纳米四氧化三铁 |
【氧化亚铁】化学式FeO,式量71.85。黑色粉末,密度5.7克/厘米3。不稳定,在空气中加热时迅速被氧化成四氧化三铁,溶于盐酸、稀硫酸生成亚铁盐。不溶于水,不与水反应。在隔绝空气条件下加热草酸亚铁制得:FeC2O4=FeO+CO+CO2
【氧化铝】化学式Al2O3,俗名矾土,白色晶体粉末,不溶于水。它有几种晶型,常见的有α型和γ型,它们的理化性质不同。α-Al2O3的熔点为2018℃,沸点为2980℃,密度为3.97克/厘米3 ,性质稳定,不溶于酸,也不易跟别的物质发生化学反应。由于它的熔点很高,可以用来做耐火材料,制造耐火坩埚、管材等。它的硬度也很高,仅次于金刚石和金刚砂(碳化硅),可用来制造钻头、轴承、砂轮等。天然产生的α-A12O3叫做刚玉,是无色晶体。有的刚玉含有少量杂质,因而呈现不同的颜色。含有微量Cr3+ 的呈红色,称红宝石;含有Fe2+ 、Fe3+ 和Ti4+ 的呈蓝色,称蓝宝石。用熔融氧化铝人工结晶的方法可以制造人造宝石,其性能不次于天然宝石。宝石可用做精密仪器和手表的轴承和装饰品。γ—Al2O3能溶于酸和碱,生成铝盐和偏铝酸盐:
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+2NaOH=2NaAlO2+H2O
γ-Al2O3硬度小,质轻,具有很大的表面积,1克γ-Al2O3表面积为200~400米2 ,比同质量的活性炭表面积大2~4倍,具有很强的吸附能力和催化活性,所以又叫做活性氧化铝,广泛用做吸附剂、催化剂或催化剂的载体。氧化铝是冶炼铝的原料。纯度99.99%的高纯氧化铝作为精细陶瓷,用做集成电路底板、机械耐热陶瓷、录音磁带的填充料,并可制人工骨骼和拉成单晶用于激光技术中。氧化铝纤维可作为增强纤维加在金属、塑料、橡胶或陶瓷中,其强度高于玻璃纤维而与碳纤维相当,在耐热性和电绝缘性方面还优于碳纤维。
 |
| 氧化铝坩埚 |
【钢】指含碳量小于2%的铁碳合金。根据成分不同,又可分为碳素钢和合金钢。根据性能和用途不同,又可分为结构钢、工具钢和特殊性能钢。
【炼 钢】根据所炼钢种的要求把生铁中的含碳量去除到规定范围,并使其它元素的含量减少或增加到规定范围的过程。简单地说,是对生铁降碳、去硫磷、调硅锰含量的过程。这一过程基本上是一个氧化过程,是用不同来源的氧(如空气中的氧、纯氧气、铁矿石中的氧)来氧化铁水中的碳、硅、锰等元素。化学反应主要是:

2FeO+Si 2Fe+SiO2
2Fe+SiO2
FeO+Mn Fe+MnO
Fe+MnO
反应生成的一氧化碳很容易从铁水排至炉气中而被除掉。生成的二氧化硅、氧化锰、氧化亚铁互相作用成为炉渣浮在钢水面上。生铁中硫、磷这两种元素在一般情况下对钢是有害的,在炼钢过程中必须尽可能除去。在炼钢炉中加入石灰(CaO),可以去除硫、磷:

2P+5FeO+3CaO 5Fe+Ca2(PO4)2(入渣)
5Fe+Ca2(PO4)2(入渣)
在使碳等元素降到规定范围后,钢水中仍含有大量的氧,是有害的杂质,使钢塑性变坏,轧制时易产生裂纹。故炼钢的最后阶段必须加入脱氧剂(例如锰铁、硅铁和铝等),以除去钢液中多余的氧:
Mn+FeO MnO+Fe
MnO+Fe
Si+2FeO SiO2+2Fe
SiO2+2Fe
Al+3FeO Al2O3+3Fe
Al2O3+3Fe
同时调整好钢液的成分和温度,达到要求可出钢,把钢水铸成钢锭。
炼钢的方法主要有转炉、电炉和平炉三种。平炉炼钢的主要特点是可搭用较多的废钢(可搭用钢铁料的20~50%的废钢),原料适应性强,但冶炼时间多。我国目前主要采用平炉炼钢。转炉炼钢广泛采用氧气顶吹转炉(见图),生产速度快(1座300吨的转炉吹炼时间不到20分钟,包括辅助时间不超过1小时,而300吨平炉炼1炉钢要7个小时),品种多、质量好,可炼普通钢,也可炼合金钢。电炉炼钢是用电能作热源进行冶炼。可以炼制化学工业需要的不锈耐酸钢,电子工业需要的高牌号硅钢、纯铁,航空工业需要的滚珠钢、耐热钢,机械工业用轴承钢、高速切削工具钢,仪表工业需要的精密合金等。

【镁】镁是第三周期ⅡA族元素,最外层电子是3s2,容易失去,因此它是比较活泼的金属元素,能跟非金属和酸等起作用。常温下镁在空气中极易氧化,生成一层致密的氧化膜,它能阻止镁继续氧化。在高温下,镁在空气中会发生燃烧,产生大量的热,放出眩目的白光,生成MgO和Mg3N2:
2Mg+O2 2MgO
2MgO
3Mg+N2 Mg3N2
Mg3N2
根据镁的这个性质,可以用镁制造照明弹和焰火。由于镁的表面常有一层保护膜,所以在常温下镁不与水起作用,但如将水加热至沸腾,则能缓慢地起作用;将镁置于高温的水蒸气中,能够迅速地反应,生成MgO和H2。
Mg+H2O MgO+H2↑
MgO+H2↑
镁跟酸能迅速地反应,生成镁盐和放出H2。
Mg+2HCl MgCl2+H2↑
MgCl2+H2↑
镁具有强的还原性,在高温下能夺取许多氧化物或卤化物的氧或卤素:
2Mg+CO2 2MgO+C
2MgO+C
TiCl4+2Mg Ti+2MgCl2
Ti+2MgCl2
因此,它可以作为还原剂应用于某些稀有金属的冶炼。
【氯化镁】化学式MgCl2,无色晶体,易溶于水,有苦咸味。
氯化镁通常含6个结晶水,MgCl2·6H2O的密度为1.56克/厘米3,熔点为118℃,同时分解。
加热时氯化镁是电解冶炼金属镁的原料,它主要来自晒制海盐的苦卤。为制得供电解用的无水氯化镁,必须在氯化氢气流中加热MgCl2·6H2O,使其脱水。氯化镁溶液与氧化镁混合,可制成用途广泛的镁质水泥。由于氯化镁易吸潮,纺织工业可用它填充织物,以保持棉花的湿度,而使其柔软。氯化镁与冰混合,可做冷冻剂。
【定义】
由两种卤素组成的二元化合物称为卤素互化物。用XXn1 表示。其中n为1、3、5、7(n的值随)rx/rx'和中心卤原子X的氧化数的增大而增加),X'的电负性比X的大,由于它们都是卤素,电负性的差值不会很大,所以它们之间都是以共用电子对相结合而形成的共价化合物,这类物质的键能和熔沸点列于下表中。
类 型 | 化合物 | 性 状 | 平均键能 | 熔 点 | 沸 点 |
XX' | ClF | 无色稳定气体 | 248 | 117.5 | 173 |
BrF | 红棕色气体 | 249 | 240 | 293 | |
IF | 很不稳定歧化为IF5和I2 | 277.8 | - | - | |
BrCl | 红色气体 | 216 | 207 | 278 | |
ICl | 暗红色固体 | 208 | 300.5 | 370 | |
IBr | 暗灰紫色固体 | 175 | 309 | 389 | |
XX3' | ClF3 | 无色稳定气体 | 172 | 197 | 285 |
BrF3 | 稳定浅黄绿色液体 | 201 | 282 | 401 | |
IF3 | 黄色固体 | ~272 | 245(分解) | ||
ICl3 | 橙色固体 | - | 384(分解) | ||
IBr3 | 棕色液体 | - | - | - | |
XX5' | ClF5 | 稳定固体(在78K以下) | 142 | 170 | 260 |
BrF5 | 无色稳定液体 | 187 | 212.6 | 314.4 | |
IF5 | 无色稳定液体 | 268 | 282.5 | 377.6 | |
XX7' | IF7 | 无色稳定液体 | 231 | 279(升华) | 277.5 |
XXn'的化学活泼性比X2的大(除F2外),绝大多数不稳定。它们是氧化剂,反应类型与卤素单质相似。它们和大多数金属、非金属生成相应的卤化物,水解时产生的卤离子和卤氧离子,卤氧离子由分子中半径较大的卤原子组成:
ICl + H2O![]() HCl + HIO(或HIO3)
HCl + HIO(或HIO3)
BrF5+3H2O![]() 5HF + HBrO3
5HF + HBrO3
【多卤化物】金属卤化物与卤素单质或卤素互化物加合所生成的化合物称为多卤化物。多卤化物通常是离子化合物。如:
KI + I2【铁氰化钾】俗名赤血盐, 化学式K3[Fe(CN)6], 式量329.25, 深红色晶体或黄色粉末, 有毒。密度1.85克/厘米3 , 溶于水, 不溶于乙醇。见光或在水溶液中都不稳定, 加热时分解。在碱性介质中是强氧化剂。铁氰化钾跟稀硫酸混合加热时即分解放出剧毒的氢氰酸。和浓硫酸作用时放出一氧化碳。跟亚铁盐溶液反应时可生成蓝色沉淀。用于印染、电镀、制革工业, 也用于制颜料、晒蓝图等。还用于测定锌的试剂、无机络合物的合成、影片洗印等方面。将氯气通入亚铁氰化钾溶液中可制得本品。 【制备】
FeSO4 + 2KCN![]() Fe(CN)2 + K2SO4
Fe(CN)2 + K2SO4
Fe(CN)2 + 4KCN![]() K4[Fe(CN)6]
K4[Fe(CN)6]
从溶液中析出来的黄色晶体是K4[Fe(CN)6]·6H2O,叫六氰合铁(Ⅱ)酸钾或亚铁氰化钾,俗称黄血盐。[Fe(CN)6]4- 离子在水溶液中相当稳定,几乎检验不出有Fe2+ 离子的存在。
在黄血盐溶液中通入氯气(或用其它氧化剂),可把Fe(Ⅱ)氧化成Fe(Ⅲ),得到六氰合铁(Ⅲ)酸钾(或铁氰化钾)K3[Fe(CN)6]
2K4[Fe(CN)6] + Cl2![]() 2KCl + 2K3[Fe(CN)6]
2KCl + 2K3[Fe(CN)6]
它的晶体为深红色,俗称赤血盐。
人们早就知道Fe3+ 离子和[Fe(CN)6]4- 离子能形成蓝色沉淀,称普鲁士蓝(Prussian blue),Fe2+ 离子和[Fe(CN)6]3- 离子能生成滕氏蓝沉淀(Turnbull's blue)。实验证明两者是相同的物质,都是六氰合亚铁酸铁(Ⅲ)。
【氯酸钾】化学式KClO3, 式量122.55。无色带珠光的小片, 或为六角的单斜晶系晶体。在空气中稳定, 溶于水, 水溶液呈中性。密度2.34克/厘米3 。溶于50%乙醇。熔点356℃。加热到400℃时分解出氧气和氯化钾, 是很强的氧化剂。跟硫、磷等接触摩擦或撞击发生爆炸。用做分析试剂、强氧化剂, 实验室制氧气, 用以制发令纸、火柴、烟火、医药、消毒剂等。氯酸钠跟氯化钾溶液混合, 利用KClO3和NaCl的溶解度受温度变化的影响不同分步结晶制得。
【氯酸及其盐 】 氯酸是强酸,其稳定性不如HBrO3和HIO3。HClO3只存在于水溶液中,未得到过纯酸,它的浓度若超过40%就会迅速分解并发生爆炸: 另外,氯酸盐还能氧化I2为HIO3:
8HClO3 ![]() 3O2 + 2Cl2 + 4HClO4 + 2H2O
3O2 + 2Cl2 + 4HClO4 + 2H2O
氯酸及其盐在酸性介质中都是强氧化剂,如能氧化Cl- ,Br- 和I- 为单质:
ClO3- + 5X- + 6H+ ![]() 3X2 + 3H2O(X=Cl,Br,I)
3X2 + 3H2O(X=Cl,Br,I)
反应的平衡常数如下: KCl=2×109 , KBr=1×1038 , KI=1.6×1044
2ClO3- + 2H+ + I2 ![]() 2HIO3 + Cl2
2HIO3 + Cl2
在碱性介质中,卤酸盐的氧化能力则相当弱。
氯酸盐中最常见的是KClO3和NaClO3。NaClO3易潮解而KClO3不会吸潮可制得干燥产品。利用KClO3溶解度较小的特点,让NaClO3与KCl进行复分解反应可得到KClO3。
NaClO3 + KCl![]() KClO3 + NaCl
KClO3 + NaCl
在有催化剂存在下,KClO3分解为氯化钾和氧,若不存在催化剂,则KClO3在629K时熔化,668K时开始按下式分解:
4KClO3 ![]() KCl + 3KClO4
KCl + 3KClO4
氯酸盐的热分解产物与组成盐的阳离子性质有关。例如碱金属,碱土金属和Ag+ 的氯酸盐其分解产物为氯化物和O2;Cd2+ ,Pb2+ ,Ni2+ 等氯酸盐的分解产物除了Cl2,O2外还有氯化物和氧化物;而Cu2+ ,Co2+ ,Zn2+ 等的分解产物为氧化物,Cl2和O2。
16Pb(ClO3)2 ![]() 14PbO2 + 2PbCl2 + 11Cl2 + 6ClO2 + 28O2
14PbO2 + 2PbCl2 + 11Cl2 + 6ClO2 + 28O2
2Zn(ClO3)2 ![]() 2ZnO + 2Cl2 + 5O2
2ZnO + 2Cl2 + 5O2
固体KClO3是强氧化剂,它与易燃物质如碳、硫、磷及有机物质相混合时,一受撞击即猛烈爆炸,因此,氯酸钾大量用于制造火柴、焰火等。
【漂白粉】由次氯酸钙、氯化钙和氢氧化钙组成的水合复盐。次氯酸钙是其有效成分(纯次氯酸钙又称漂白精)。白色粉末状物质, 有氯气气味, 这是因为漂白粉吸收空气中的水和二氧化碳, 在光照条件下分解, 放出游离氯, 漂白粉即失效, 反应式为
Ca(ClO)2+H2O+CO2=CaCO3+2HClO 2HClO=2HCl+O2↑
Ca(ClO)2+4HCl=CaCl2+2Cl2↑+2H2O
漂白粉有较强的氧化性和漂白作用。通常漂白粉中的有效氯(即一定量的漂白粉跟过量酸作用放出氯气所占样品重量的百分数)约含35%。漂白粉可用于漂白棉、麻、纸浆, 也是一种廉价有效的消毒剂、杀虫剂。将氯气通入消石灰中, 经干燥制得。
【碘酸】化学式HIO3, 式量175.91。无色正交晶体, 密度4.629克/厘米3, 熔点110℃, 加热到110℃时, 开始转变为HI3O8。195℃时完全脱水而成五氧化二碘I2O5。加热到300℃以上才分解为碘和氧气。是强酸, 浓溶液有强氧化性。用作化学试剂、强氧化剂、制药物。用强氧化剂如Cl2、O3、HNO3、H2O2等氧化碘可制得纯碘酸, 如:
I2+10HNO3(浓)=2HIO3+10NO2↑+4H2O
【碘酸及其盐】
碘酸HIO3比氯酸和溴酸都稳定,是一种白色固体。它受热时分解为I2和O2:
2HIO3![]() I2O5 + H2O
I2O5 + H2O
4HIO3 ![]() 2I2 + 5O2 + 2H2O
2I2 + 5O2 + 2H2O
碘酸是中强酸,它的浓溶液是强氧化剂,但氧化性不如溴酸和氯酸,所以单质碘能从溴酸盐或氯酸盐的酸性溶液中置换出单质溴和氯:
2BrO3- + 2H+ + I2![]() 2HIO3 + Br2
2HIO3 + Br2
2ClO3- + 2H+ + I2![]() 2HIO3 + Cl2
2HIO3 + Cl2
在酸性介质中,碘酸盐能氧化碘离子生成单质碘:
IO3- + 5I- + 6H+ ![]() 3I2 + 3H2O
3I2 + 3H2O