
|
学习小专题 |
【定义】由两种或两种以上的简单盐类组成的同晶型化合物,叫做复盐。
【说明】
1.复盐又叫重盐。复盐中含有大小相近、适合相同晶格的一些离子。例如,明矾(硫酸铝钾)是KAl(S04)2·12H20,莫尔盐(硫酸亚铁铵)是(NH4)2Fe(S04)2·6H20,铁钾矾(硫酸铁钾)是KFe(S04)2·12H20。
2.复盐溶于水时,电离出的离子,跟组成它的简单盐电离出的离子相同。例如,KAl(S04)2=K++A13++2SO42-
3.使两种简单盐的混合饱和溶液结晶,可以制得复盐。例如,使CuS04和(NH4)2S04的溶液混合结晶,能制得硫酸铜铵[(NH4)2S04 ·CuS04 ·6H20]。
4.由两种不同的金属离子和一种酸根离子组成的盐。例如硫酸铝钾[KAl(SO4)2],十二水合硫酸铝钾[KAl(SO4)2·12H2O]俗称明矾。明矾也可用化学式K2SO4·Al2(SO4)3·24H2O表示,是无色晶体,溶于水完全电离产生三种离子,Al3+水解形成Al(OH)3胶体,水溶液呈酸性。
Al(OH)3有很强的吸附能力,它吸附水中悬浮的杂质形成沉淀。因此,明矾可作净水剂,还可作收敛剂和媒染剂。
5.氯化镁钾[KMgCl3]也是复盐。自然界的KCl·MgCl2·6H2O,俗称光卤石,易溶于水。从光卤石可提取KCl和MgCl2。复盐和复盐的水合物都属于纯净物。
【结晶水合物】含有结晶水的固体物质,叫做结晶水合物。
说明
1.结晶水合物中的水分子是以确定量存在的,如FeCl3·6 H20、 FeS04·7 H2O、 Ba (OH) 2 · 8 H2O和ZnS04 ·7 H2O 等。因此,结晶水合物是纯净物。
2.水合物中的水分子有各种结合方式。一种是作为配位体,配位在金属离子上,叫配位结晶水。另一种结合在阴离子上,叫阴离子结晶水。例如,CuS04·5 H20加热到113℃,只失去4分子,加热到258℃才能脱去最后1分子水。由此推断,它的结构是[Cu(H2O)4]2+[S04(H20)]2-3.含有结晶水的物质叫做结晶水合物。又称水合物、水化物。如绿矾(FeSO4·7H2O)、二水合硫酸(H2SO4·2H2O)、六水合氯化铁(FeCl3·6H2O)等。除水合离子外,结晶水合物大多是晶态物质。结晶水合物在受热时会失去结晶水,并有显著的吸热效应。
【定义】主要以共价键结合形成的化合物,叫做共价化合物。
【说明】
1.不同种非金属元素的原子结合形成的化合物(如CO2、ClO2、B2H6、BF3、NCl3等)和大多数有机化合物,都属于共价化合物。在共价化合物中,一般有独立的分子(有名符其实的分子式)。通常共价化合物的熔点、沸点较低,难溶于水,熔融状态下不导电,硬度较小。
2.有些离子型化合物中也可能存在共价键结合。例如NaOH分子中既有离子键又有共价键。有些共价化合物中局部区域也可能包含离子键的成分,例如苯酚钠等。
3.以共价键结合的有限分子(即共价化合物分子),且靠分分子间范德华力作用而凝聚成的晶体,是典型的分子晶体,如CO2晶体、苯的晶体等。以共价键结合的无限分子形成的晶体属于共价型晶体或原子晶体,它是由处于阵点位置的原子通过共价键结合而成的晶体,如金刚石晶体、单晶硅和白硅石(SiO2)晶体。【定义】阳、阴离子之间通过离子键结合而形成的化合物为离子化合物。
【说明】
1. 离子化合物的形成可以用电子式表示:如氯化铵形成的电子式为:
2.离子化合物在室温下以离子晶体形式存在,不存在单个的离子化合物分子。NaCl、MgO、CaF2等实际上只是表示离子晶体中阳、阴离子个数的简单整数比和重量组成比的化学式,不是分子式。只有在气态时才有离子型分子。
3.离子化合物的熔点,与离子所带电荷、离子半径和离子的核外电子排布等结构特征有关。一般说来,阳、阴离子所带的电荷越多、离子半径越小,离子化合物的熔点越高。如果离子化合物的其他特征相同,则阳、阴离子的核间距越大,它们的熔点越低。
4.大多数离子化合物易溶于水,难溶于有机溶剂。离子化合物在水溶液中和在熔融状态下都有能自由移动的离子,因此能导电。
【定义】含有过氧基(一O一O一)的化合物叫做过氧化物。
【说明】
1.过氧化物中氧的氧化数是-l。过氧化物包括过氧化氢(H202)、金属过氧化物、过氧酸盐和有机过氧化物。过氧化物可以看作是过氧化氢的衍生物。
2.金属过氧化物只是碱金属和碱土金属中存在过氧化物,例如Na202、Ba02等。常见的过氧酸有过二硫酸及其盐、过二磷酸等。有机过氧化物有过氧乙酸、过氧化苯甲酰等。
3.过氧化物都是强氧化剂,加热时放出氧气,跟稀酸反应能生成过氧化氢。
Ba02+H2S04=H202+BaS04
【定义】氢跟其它元素组成的二元化合物。例如氢化钠、硫化氢、硼烷等。
【说明】
按其结构大致可分成三种类型:
1. 离子型氢化物(又叫盐型氢化物)碱金属和碱土金属中 的钙、锶、钡能跟氢气在高温下反应、,生成离子型氢化物,如NaH、 CaH2等,其中氢以H-离子形式存在。这类氢化物都是离子晶体,熔点较高,在熔融状态下能导电。它们都有强还原性,遇水分解,生成金属氢氧化物,并放出氢气。
2. 共价型氢化物(又叫分子型氢化物)氯化氢、氨、硫化氢、 甲烷等在常温下呈气态或液态,水在常温下呈液态。这类氢化物 性质差异较大,如HX、H2S溶于水时电离而显酸性,NH3溶于水 显碱性,CH4水不发生任何作用,SiH4发生反应:SiH4 + 4H20= H4Si04 + 4H2。
3. 金属型氢化物 铍、镁、铟、钛和d区、f区金属元素的单质都能跟氢生成金属氢化物,如BeH2、MgH2、FeH2、CuH等,还 有非整数比化合物,如VH0.56、ZrH1.92、PdH0.8等。金属型氢化 物保留金属的外观特征,有金属光泽,密度比相应金属小。据最新研究,金属型氢化物在有机合成及作储氢材料方面有重要用途。 例如,1体积钯可吸收700~900体积的氢气成为金属氢化物,加热后又释放出氢气。
【定义】由非金属元素组成的单质。非金属一般没有金属光泽,不是电和热的良导体,没有延性和展性。在通常情况下,非金属有的是固体,有的是气 体,只有溴是液体。非金属固体大多数是分子晶体,硬变小,熔点、沸点较低,但有的非金属固体属原子晶体,如金刚石、晶体硅等,它们的硬度大,熔点、沸点较 高。非金属元素的原子价电子较多,原子半径较小,在化学反应中倾向于得到电子。大多数非金属既具有氧化性,又具有还原性。金属与非金属没有严格界限,位于 周期表P区左上到右下对角线附近的元素,如硼、硅、锗、砷、锑、碲等既具有非金属的性质,又具有金属的性质,可把这些元素的单质称为准金属或半金属。
【说明】
1.非金属正好跟金属相反,一般无金属光泽,缺乏延展性,是电和热的不良导体。在通常状况下,非金属有的是固体,有的是气,只有溴是液体。非金属固体中金
刚石、晶体硅、晶体硼是原子晶体,熔点和沸点都很高:硬度也大。其他非金属固体属于分子晶体,熔点、沸点较低,硬度小。
2.非金属元素原子的价电子较多,在化学反应中倾向于得到电子,具有氧化性,容易跟金属化合。非金属元素之间相结合时,其中非金属性较弱的元素会部分失去电子,显示还原性,大多数非金属能跟氧结合成酸性氧化物。
3.非金属与金属之间没有严格的界限。例如硼、硅、锗、砷、锑、硒、碲等既有金属的性质,又有非金属的性质,有时把它们叫做半金属(也有叫做准金属)。
【定义】由金属元素组成的单质。具有金属光泽、不透明、有延性和展性、有良好的传热性和导电性的一类物质。在金属晶体中有中性原子、阳离子和自由电子,金 属具有上述性质,都与晶体中存在自由电子有关。常温下除汞外,都以固态形式存在。化学性质一般表现较强的还原性,由于金属元素原子的价电子较少,原子半径 较大,在反应中容易失去价电子成为阳离子的缘故。工业上通常把金属分为黑色金属和有色金属两大类。有色金属又可分成轻金属、重金属、贵金属和稀有金属等。
【分类】
1、黑色金属:通常是指铁、铬、锰和铁的合金(主要指钢铁)。在各种金属中,铁在地壳中分布较集中,储量较丰富,开采和冶炼较多,价格也较廉。铸铁和钢的品种和 规格很多,它们是工业上最广泛应用的金属材料,在国民经济中占有极重要的地位。铬与锰主要应用于制合金钢。铁、铬、锰及其合金都不是黑色的,而钢铁表面经 常覆盖着一层黑色的四氧化三铁。这样分类,主要是从钢铁在国民经济中的重要地位出发的。
2、有色金属:通常是指除铁、铬、锰和铁的合金以外的其它金属。可分为四类:(1)重金属,如铜、锌、铅、镍等。(2)轻金属,如钠、钙、镁、铝等。(3)贵金属,如金、银、铂、铱等。(4)稀有金属,如锗、铍、镧、铀等。
a、重金属:一般是指密度在4.5克/厘米3以上的金属。例如铜、锌、钴、镍、钨、钼、锑、铋、铅、锡、汞等,过渡元素大都属于重金属。也有把密度在5克/厘米3以上的金属称为重金属的。
b、轻金属:一般是指密度在4.5克/厘米3以下的金属。例如钠、钾、镁、钙、铝等。周期系中第一、二主族均为轻金属。也有把密度在5克/厘米3以下的金属称为轻金属的。
c、贵金属:通常是指金、银和铂族金属(包括钌、铑、钯、锇、铱、铂)。这些金属在地壳中含量较少,不易开采,价格较贵,所以叫贵金属。这些金属对氧和其它试剂较稳定,金和银常用来制造装饰品和硬币。
d、稀有金属:通常是指自然界中含量较少,比较分散的金属。它们难于从原料中提取,在工业上制备及应用较晚。稀有金属和普通金属没有严格界限,某些稀有金属比
铜、汞、镉等金属还多。稀有金属在现代工业中具有重要的意义,往往把黑色金属、有色金属和稀有金属并列为三大类。稀有金属根据其在地壳中的分布状况及冶炼
方法,可分为六类:(1)稀有轻金属,如锂、铷、铯、铍、钛等。(2)稀有难熔金属,如钨、钼、铌、钽、铪、钒等。(3)稀有分散金属(或称稀散金属),
如镓、铟、铊、锗等。(4)稀土金属,包括钪、钇和镧系元素。(5)稀有贵金属,指铂族元素。(6)稀有放射性金属:包括钋、钫、镭、锕、钍、镤、铀以及
从1940年以来陆续发现的十多种人造放射性元素。
【说明】
1.金属具有特殊的金属光泽(对可见光强烈反射)、富有延性和展性,是电和热的良导体等性质。
2.金属的上述特性都跟金属晶体里含有自由电子有关。在金属晶体中有中性原子、金属阳离子和自由电子。自由电子能在整个晶体中自由移动。
①当光线照射到金属表面时,自由电子吸收所有频率的可见光,然后很快发射出大部分所有频率的可见光,这就使绝大多数金属显出银白色或钢灰色的光泽。金属在
粉末状态时,晶体排列不规则,可见光吸收后难以发射出去,所以金属粉末一般呈暗灰色或黑色。少数金属如金、铝等,它们的粉末仍保持原有的颜色和光泽。
②自由电子在金属晶体里作不规则的运动,在外电场的作用下,自由电子会作定向移动,形成电流,这就是金属容易导电的原因。
⑧当金属的一部分受热时,受热部分的自由电子的能量增加,运动加剧,不断跟金属离子碰撞而交换能量,把热量从一部分传向整块金属,因而金属有良好的导热性。
④当金属受到外力作用时,金属晶体内某一层金属原子、离子跟另一层金属原子、离子发生相对滑动,由于自由电子的运动,各层间仍保持着金属键的作用力,所以金属具有良好的延展性。只有少数金属,如锑、铋、锰性质比较脆。
3.金属在通常状况下,除汞是液体外,其余都是固体。导电、导热性最好的是银,延性铂最突出,展性金最优越,密度最大的是锇(在25℃是22. 57 g/cm3),硬度铬最高,熔点最高的是钨(3410℃)。
4.金属元素原子的价电子较少,在化学反应中容易失去电子,所以金属一般表现还原性。
5.工业上常常把金属分为黑色金属和有色金属两大类。有又可分为轻金属、重金属、贵金属、稀有金属和半金属等类别。
6.金属除铜、金、铂和铋等以游离态存在外,极大多数以化合态存在于自然界中。金属的矿物通常以氧化物或硫化物的形式存在,较少的氯化物、硫酸盐、碳酸
盐、硅酸盐等形式存在于自然界。业上常在高温下用碳、一氧化碳或氢气还原、电解水溶液或熔融盐、用活泼金属(如Al、Ca、Mg、Na)热还原等方法提炼金属。
【混和物】由几种不同的单质或化合物通过机械混和而成的物质。混和物没有固定的组成,混和物中各成分仍保持各自原有的性质,可以利用混和物中所含各成分的不同物理性质进行分离,例如空气中所含的氮气、氧气、惰性气体等可利用它们的沸点不同而分离开来。
说明
1.混合物跟化合物不一样,它没有固定的组成。混合物中各组分仍保持各自原有的性质。
2.混合物中各组分之间可以均匀地分散(如溶液)或非均匀地分散(如浊液或固体混合物),但互相不发生化学反应。由于不同组分之间相互吸引或排斥,可能影响混合物的整体特性。例如,由几种液体形成的混合物,总体积一般不等各种液体分体积的和。
3.混合物能根据它所含各组分的物理性质(如溶解度、沸点、密度、磁性等)的不同,用物理方法(如结晶、升华、蒸馏、萃取等操作)加以分离。
4.我国中学化学教材中长期把混合物写成混和物,把混合写成混和,现在已经改正。
【定义】由不同种元素组成的纯净物。化合物具有固定的组成并具有一定的性质。化合物从成分上可分为有机物和无机物两大类,从构成化合物的化学键又可分为离子化合物和共价化合物两大类。
【说明】【定义】由同种元素组成的纯净物。单质不可能再分解成两种或两种以上的不同物质。例如氧气(O2)、磷(P4)、铁(Fe)、银(Ag)等。单质和元素是两个不同的概念,元素是具有相同核电荷数的同一类原子的总称,元素以游离态存在时为单质,有些元素可以形成多种单质,例如碳元素可以形成金刚 石、石墨和无定形碳等多种单质。根据单质的不同性质,一般单质可分为金属和非金属两大类。
【定义】由一种单质或一种化合物组成的物质。
纯净物具有固定的组成、结构和性质,例如纯净的水无色透明、无味。密度是1克/毫升,熔点0℃, 沸点100℃。自然界里纯净物极少,根据生产和科学实验的要求,可按物质不同性质进行提纯。实际上绝对纯的物质是不存在的,凡含杂质的量不至于在生产和科 学实验过程中发生有害影响的物质,就当作纯净物,如作半导体材料的高纯硅,其纯度为99.999999999%,也不是完全纯净的。因此,纯净物一般是指 含杂质很少具有一定纯度的物质。
【说明】
1.纯净物都有固定的组成,可以用一定的化学式表示。纯净物不能用物理方法而只能用化学方法把各组成元素分开。
2.实际上完全纯的物质是没有的。一种物质,它所含杂质的量不至于在生产和科研中发生有害影响,这种物质可以看作纯净物。一般说的纯净物,它们的纯度有差
别。例如,化学试剂按纯度由低到高可分为工业纯、实验纯(L.R)、化学纯(C.P)、分析纯(A.R)、优级纯(G.R)和超纯等多种规格。
3.在实验中选用试剂的纯度等级过高,会因价格过高而造成不必要的浪费;选用试剂纯度等级过低,会因试剂中的杂质干扰而造成实验失败。应该根据用途不同,选用纯度相当的试剂或原料。
许多物质从水溶液中形成晶体析出时,晶体里常结合一定数目的水分子。这样的水分子叫做结晶水。如胆矾(CuSO4·5H2O)中就含有结晶水。
一般指中心原子获得电子显示氧化性的酸。如浓硫酸、硝酸、氯酸、高氯酸、高锰酸、重铬酸等,其中心原子在氧化-还原反应中容易获得电子而显示氧化性,可用作氧化剂。任何酸的水溶液中都不同程度地电离出H+,H+在一定条件下可获得电子而形成H2,这也是酸的氧化性的表现,实质上是H+的一种性质。应该与酸的中心原子获得电子所呈现的氧化性区别开来。通常把盐酸、稀硫酸等称作为非氧化性酸。
【定义】在氧化-还原反应中失去电子(或电子对偏离)的反应物。在反应中还原剂中元素的化合价(或氧化数)升高。还原剂能还原其它物质而自身在反应中被氧化。
【说明】
1、还原剂能还原其他物质而自身被氧化。它失去电子后,自身的化合价(或氧化数)升高。
2、还原剂通常是指容易失去电子的物质,常见的有:
(1)活泼金属,如钠、钾、镁、铝、铁等。
(2)具有低化合价(氧化数)的金属离子,如Fe2+、Sn2+等。
(3)非金属离子,如I-、S2-等。
(4)含有低化合价(氧化数)元素的含氧化合物,如CO、SO2、Na2SO3、Na2S2O3、NaNO2等。
3、根据还原剂失去电子的难易程度,可分为弱还原剂和强还原剂,定量地判断还原剂还原能力的大小,应根据该还原剂及其氧化产物所组成的氧化还原电对的标准电极电位E0值来确定,E0值越负,表明该还原剂的还原能力越强。

【定义】 盐是指一类金属离子或铵根离子与酸根离子或非金属离子结合的化合物。如NaCl、(NH4)2SO4、Cu2(OH)2CO3、KHCO3等。在常温时,盐一般为晶体。它们在水中的溶解性各不相同,钾盐、钠盐、硝酸盐和铵盐很容易溶解;有些盐很难溶解,如AgCl和BaSO4等。铵盐和碳酸盐、硝酸盐、亚硝酸盐、重铬酸盐、高锰酸盐等含氧酸的盐稳定性较差,受热时可以分解。大多数盐是强电解质,其水溶液或熔液能够导电。但有些盐(如HgCl2)的水溶液几乎不导电,它在水溶液中主要以分子状态存在。根据组成的不同,盐可以分为无氧酸盐、含氧酸盐、正盐、酸式盐、碱式盐、复盐、络盐等。
【说明】
1.根据组成不同,盐可以分成正盐、酸式盐、碱式盐、复盐和 络盐等。既不含可以电离的氢原子,又不含氢氧根,这种盐叫正 盐。由金属离子和含有可以电离的氢原子的酸根所组成的盐,叫 做酸式盐,如NaHC03和NaH2P04。它们分别叫碳酸氢钠和磷 酸二氢钠。除金属离子和酸根以外,还含有一个或几个氢氧根, 这种盐叫碱式盐,如:Cu2(OH)2C03、Mg(OH)Cl、(BiO)Cl 和 (BiO)2C03。它们分别叫做碱式碳酸铜、碱式氯化镁、碱式氯化 铋(或氯化氧铋)和碱式碳酸铋(或碳酸氧化铋)。上述后面的f种 物质是碱式盐失水后的产物,如Bi(OH)2Cl失水后成(BiO)Cl。
2.在常温下,盐一般是晶体。大多数盐能溶于水,如钾盐、钠 盐、铵盐、硝酸盐等。
3.有些盐受热时容易分解,如铵盐、碳酸盐、硝酸盐、重铬酸 盐和高锰酸盐。但是盐都比相应的酸稳定,例如,就稳定性说, Na2C03>NaHC03>H2C03
4.大多数盐是电解质,它们的水溶液或在熔融状态下能够导 电。有些盐(如HgCl2)由于发生离子极化作用,键性从离子键转向共价键,它们的水溶液不导电。
【苛性碱】碱金属氢氧化物的总称。一般指的是苛性钠(NaOH)和苛性钾(KOH)。由于它们对皮肤、羊毛、纸张、木材等具有强烈的腐蚀性而得名。
【碱】电解质电离时所生成的阴离子全部是氢氧根离子(OH-)的化合物。例如NaOH、Ca(OH)2、NH3·H2O等。能跟酸性氧化物或酸反应生成盐和水,碱的水溶液有涩味,可使紫色石蕊试液变蓝。根据碱的电离程度,可以分为强碱(如NaOH、Ca(OH)2)和弱碱(如NH3·H2O)。根据碱电离时产生的氢氧根离子的数目可分为一元碱(如NaOH)、二元碱(如Ca(OH)2)、多元碱(如Fe(OH)3)等。此外,根据酸碱的质子理论和电子理论,还有质子碱和路易斯碱,因而使得“碱”这个概念包括的范围极为广泛,而且又赋予它新的含义。
【说明】
1.根据碱在水溶液中的电离程度,碱分成强碱和弱碱。能全 部电离的是强碱,包括碱金属和钙、锶、钡的氢氧化物;只能部分电离的是弱碱,其他的氢氧化物都是弱碱。
 H+ +B(碱)
H+ +B(碱) H+ +NH3
H+ +NH3 H+ +CO32-
H+ +CO32- H+ +HCO3-
H+ +HCO3-【过氧酸】简称过酸。分子中含有过氧基(-O—O-)的酸。例如过硫酸H2SO5和过二硫酸H2S2O8等。过氧酸可以看成是H2O2中的氢原子被酸根取代的产物。
【酸】电解质电离时所生成的阳离子全部是氢离子(H+)的化合物。它能和碱或碱性氧化物反应生成盐和水,能与某些金属反应生成盐和氢气,水溶液有酸味并能使指示剂变色,如紫色石蕊变红。根据酸分子中可被金属原子置换的氢原子数目,可分为一元酸(如HCl)、二元酸(如H2SO4)、多元酸(如H3PO4)等。根据酸在水溶液中产生氢离子程度的大小(即电离度的大小),可分为强酸(如HCl、H2SO4、HNO3、HClO4等)和弱酸(如H2CO3、H2S等)。根据酸根的组成成分又可分为含氧酸(如H2SO4)和无氧酸(如HCl)。此外,根据酸碱的质子理论和电子理论,还有质子酸和路易斯酸等,因而使得“酸”这个概念包括的范围极为广泛,而且又赋予它新的含义。
【说明】
1. H30+(水合氢离子)是H+和H20结合而成的。在书写电离方程式时,为了简便起见,通常仍以H+代替H30+ 。
2. 根据酸在水溶液中电离度的大小,酸分为强酸和弱酸。根据酸分子中可以电离的氢原子个数,酸分为一元酸(如HNO3)、 二元酸(如H2S04)和三元酸(如H3P04)。根据酸中是否含氧,酸分为含氧酸和无氧酸。
3. 无氧酸称氢某酸。如HF叫氢氟酸,H2S叫氢硫酸。在无氧酸中,HC1、HBr和HI是强酸,其余都是弱酸。简单含氧酸 通常叫某酸,如硫酸(H2S04)、碳酸(H2CO3)。某一成酸元素如果能形成多种含氧酸,就按成酸元素的氧化数高低命名,如高氯酸 (HClO4、氯酸(HC103)、亚氯酸(HC102)、次氯酸(HClO)。两个简单含氧酸缩去一分子水而形成的酸,叫做焦酸(或称一缩某酸、重酸),例如,2H2S04 = H2S207(焦硫酸)+H20;2H2Cr04=H2Cr207(重铬酸)+H2O
酸分子中的氢氧塞数等于成酸元素的氧化数,这种酸叫原某酸,如 原磷酸[P(OH)5 即 H5PO5],原硅酸[Si(OH)4,即 H4Si04]。一个正酸分子失去一分子水而形成的酸,叫做偏某酸,如偏磷酸 (HP03)、偏硅酸(H2Si03)。含有过氧键(一0—O—)的酸叫过酸,如过一硫酸(H2SO5),过二硫酸(H2S2O8)。
4. 把含氧酸的化学式写成MOm(OH)n(M是非金属),就 能根据m值判断常见含氧酸的强弱。
m=0,极弱酸,如硼酸(H3B03)。
m=1,弱酸,如亚硫酸(H2S03)。
m=2,强酸,如硫酸(H2S04)、硝酸(HN03)。
m=3,极强酸,如高氯酸(HC104)。
5. 强酸在水溶液中完全电离;弱酸在水溶液中存在电离平衡 HA H+ + A-。
H+ + A-。
K=[H+][A-]/[HA]
电离平衡常数K随弱酸的浓度和温度不同,变化不大。
6. 定义2是根据酸碱质子理论对酸下的定义。
A  H+ +B
H+ +B
HC1= H++Cl-
H2PO4-  H+ +HPO42-
H+ +HPO42-
NH4+ H+ +NH3
H+ +NH3
HC1、H2SO4叫分子酸,H2P04-、NH4+叫离子酸,A和B互为共轭酸碱对。
【定义】
氧元素跟其它元素形成的二元化合物。如氧化钙、二氧化硫、一氧化氮等。氧化物可分为不成盐氧化物(如一氧化碳、一氧化氮等)和成盐氧化物 两类,后者又分为碱性氧化物(如氧化钙)、两性氧化物(如氧化铝)和酸性氧化物(如二氧化碳)。此外还有过氧化物、超氧化物、臭氧化物等。同一种元素往往 有几种不同价态的氧化物,如SO2和SO3;FeO、Fe2O3和Fe3O4等。有时氧化物的含义更广泛,不限于含氧元素的二元化合物,如多元氧化物(如NiFe2O4)和有机氧化物(如氧化乙烯C2H4O2,即环氧乙烷)等。
【分类】
1、不成盐氧化物:又称惰性氧化物或中性氧化物。是既不能跟酸起反应,又不能跟碱起反应的氧化物,如CO和NO等。
2、碱性氧化物:能跟酸起反应,生成盐和水的氧化物。金属氧化物大多数是碱性氧化物,如氧化钙、氧化铜等。碱性氧化物对应的水化物是碱,例如CaO对应的水化物是Ca(OH)2,CuO对应的水化物是Cu(OH)2等,多数碱性氧化物不能直接跟水化合,有些碱性氧化物如CaO能跟水化合生成碱。CaO+H2O=Ca(OH)2,碱性氧化物一般由金属直接氧化或难溶性碱、含氧酸盐受热分解制得。
3、两性氧化物:既能跟酸起反应生成盐和水,又能跟碱起反应生成盐和水的氧化物。例如氧化铝、氧化锌等,某些过渡元素的中间价态的氧化物,如Cr2O3和Mn2O3等也是两性氧化物。两性氧化物对应的水化物是两性氢氧化物。
4、酸性氧化物:能跟碱起反应,生成盐和水的氧化物。非金属氧化物多数是酸性氧化物,某些过渡元素的高价氧化物(如CrO3、Mn2O7等)也是酸性氧化物。酸性氧化物也叫酸酐,例如SO3叫硫酐,CO2叫碳酐。酸性氧化物对应的水化物是含氧酸,如SO3对应的水化物是H2SO4,CO2对应的水化物是H2CO3,SiO2对应的水化物是H2SiO3等。酸性氧化物多数能跟水直接化合生成含氧酸,少数酸性氧化物(如SiO2)不能直接跟水反应。酸性氧化物一般由非金属直接氧化或含氧酸、含氧酸盐受热分解制得。
【说明】
1.除了有些稀有气体以外,实际上已制得所有元素的氧化物。根据不同的标准,氧化物有以下几种分类。
(1)按酸碱性分,一般分酸性氧化物(如三氧化硫)、碱性氧化物(如氧化钠)、两性氧化物(如氧化铝)和不成盐氧化物(如一氧化氮)。
(2)按价键特征分,有离子型氧化物(如氧化钠)和共价型氧化物(如二氧化碳)。
(3)按晶体结构分,有无限三维晶格氧化物(如二氧化钛)、层状晶格氧化物(如三氧化钼)、链状晶格氧化物(如三氧化铬)和分子结构氧化物(如二氧化碳)。
2.同种元素往往有几种不同价态的氧化物,如SO2和SO3,As2O3和As2O5,FeO、Fe2O3和Fe3O4等。在Fe3O4中,Fe有两种不同的价态,一般把Fe3O4看作是FeO·Fe2O3,经x射线研究证明,它是一种铁(Ⅲ)酸盐,化学式是FeⅡFeⅢ[Fe3Ⅲ4]。
3.有人认为氧化物是指氧跟电负性比氧小的元素所形成的二元化合物。从这个观点看,OF2不属于氧化物,而属于氟化物。
4.氧化物中还有过氧化物(如过氧化钠、过氧化氢)和超氧化物(如超氧化钾KO2)。过氧化物和超氧化物都具有强氧化性。
5.有时氧化物的含义比较广泛,如NiFe2O4、YVO4、 Y3Al5O12等叫混合氧化物或多元氧化物。还有一类叫有机氧化物,如C2H4O2叫环氧乙烷或氧化乙烯、C3H6O叫环氧丙烷或氧化丙烯。
6.同周期元素的氧化物,随着原子序数的递增,碱性减弱而酸性增强。同族元素的氧化物,随着原子序数的递增,碱性增强而酸性减弱。同种元素形成不同价态的氧化物时,随着价态的递增,氧化物的酸性增强。
【定义】简称酐。含氧酸脱水后生成的氧化物或羧酸的分子间和分子内脱水缩合而产生的有机物,都叫做酸酐。例如三氧化硫SO3为硫酐,可看作H2SO4分子缩去一个分子水而成;五氧化二磷(P2O5)为磷酐,可看作两个H3PO4分子缩去三个水分子而成;醋(酸)酐(CH3CO)2O,可以看作由两个醋酸CH3COOH分子缩去一个分子水而成。酸性氧化物也叫酸酐,但酸酐不一定是氧化物,例如醋酐。
【说明】
1.SO3、N2O5、P2O5分别是 H2SO4、HNO3、H3PO4的酸酐,叫做硫酸酐(简称硫酐)、硝酸酐、磷酸酐。酸酐中的成酸元素跟对应水化物(即含氧酸)中的成酸元素,如SO3和H2SO4,N2O5和HNO3,它们的化合价相同。
2.通常酸酐跟水化合而生成对应的酸。
SO3+H2O =H2SO4 N2O5+H2O=2HNO3
个别酸酐不能跟水反应,如SiO2不溶于水,但H2SiO3的酸酐仍是SiO2
3.有时候酸酐跟水结合能生成几种酸,则该酸酐同时成为几种酸的酸酐。例如,P2O5跟不同数目的水分子结合,能生成偏磷酸(HPO3)、磷酸(H3PO4)和焦磷酸(H4P2O7)等。
4.大多数含氧酸的酸酐是非金属氧化物,但也有一些是金属氧化物。例如高锰酸(HMnO4)的酸酐是Mn2O7,重铬酸(H2Cr2O7)的酸酐是CrO3。
5.有机酸酐不是氧化物,例如,乙酸酐是由乙酸分子间脱水而得到的。有的有机酸酐是由分子内缩水而得到的。通常用脱水剂(如P2O5、乙酸酐)跟羧酸共热而脱水来制有机酸酐。
【无机物】是无机化合物的简称,通常指不含碳元素的化合物。但少数含碳的化合物,如一氧化碳、二氧化碳、碳酸盐、氰化物等也属无机物。无机物大致可以分为氧化物、碱、酸和盐四大类。
【定义】碱中的氢氧根离子部分被中和的产物,它是由金属阳离子、氢氧根离子和酸根阴离子组成的。例如碱式氯化镁[mg(OH)Cl]、碱式碳酸铜[Cu2(OH)2CO3]。
【说明】
1、Na2CO3溶液加入铜盐溶液得到绿色Cu2(OH)2CO3沉淀。自然界存在的Cu2(OH)2CO3俗称孔雀绿。
2、碱式盐的溶解度一般不大,但溶于强酸,受热的分解,例如:
Cu2(OH)2CO3==2CuO+CO2↑+H2O
【定义】酸中的氢离子部分被碱中和的产物,它是由金属阳离子(或铵根离子)和酸式酸根离子组成,例如KHSO4、NaHCO3、NH4HCO3等。
【说明】
1、大多数酸式盐的溶解度大于正盐,例如Ba(HCO3)2、Ca(H2PO4)2在水中易溶而BaCO3、Ca3(PO4)2难溶。NaHCO3在水中 的溶解度小于CO2,往饱和的Na2CO3溶液中通入足量CO2,便可析出NaHCO3晶体。
2、酸式盐的水溶液不一定显酸性。KHSO4在水中完全电离出 H+、K+、SO42-;NaHCO3溶液中,HCO3-离子既能电离产生H+,又能水解产生OH-,由于水解趋势大于电离趋势,溶液呈弱碱性;NaH2PO4溶液,水解趋势小于电离趋势,溶液呈弱酸性;
3、弱酸酸式盐有两性,既能跟酸反应,又能跟碱反应。例如:
Ca(H2PO4)2+2Ca(OH)2==Ca3(PO4)2↓+4H2O
NaHCO3+HCl==NaCl+H2O+CO2↑
4、含氧酸的酸式盐,其热稳定性一般小于正盐,大于相应的酸,例如:CaCO3> Ca(HCO3)2> H2CO3
5、常温酸式盐可由多元酸与适量的碱式盐反应生成,例如:
NaOH+CO2==NaHCO3
NaCl固+H2SO4浓==NaHSO4+HCl↑
Ca3(PO4)2+4H3PO4==3Ca(H2PO4)2
【正盐】金属阳离子(或铵离子)和酸根阴离子组成的化合物。正盐是酸跟碱完全反应(中和完全)的产物。例如,磷酸与氢氧化钠完全反应:
H3PO4+3NaOH Na3PO4+3H2O
Na3PO4+3H2O
若多元酸未被碱完全中和,则生成酸式盐:
H3PO4+NaOH NaH2PO4+H2O
NaH2PO4+H2O
H3PO4+2NaOH Na2HPO4+2H2O
Na2HPO4+2H2O
多元碱未被酸完全中和,则生成碱式盐:
Mg(OH)2+HCl Mg(OH)Cl+H2O
Mg(OH)Cl+H2O
由此可见,多元酸(或碱)与碱(或酸)反应生成的盐,究竟是正盐、酸式盐,还是碱式盐,取决于反应物的物质的量之间的比值。参看酸式盐、碱式盐。
【两性氢氧化物】既能跟酸反应,又能跟碱反应,分别生成盐和水的氢氧化物,例如Al(OH)3和Zn(OH)2。两性金属氢氧化物都难溶于水。Al(OH)3 溶于盐酸生成铝盐,溶于NaOH溶液生成偏铝酸盐。
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
氢氧化物的两性是由它既能进行酸式电离,又能进行碱式电离决定的,例如Al(OH)3在水中:
AlO2- +H+ +H2O Al(OH)3
Al(OH)3 Al3+ +3OH-
Al3+ +3OH-
未溶的Al(OH)3与两种电离产生的离子建立动态平衡。当加入盐酸时,平衡向右移动,Al(OH)3继续溶解,发生碱式电离产生OHˉ,与盐酸中和生成AlCl3和H2O;当加入NaOH溶液时,平衡向左移动,Al(OH)3也继续溶解,发生酸式电离产生H+ 与NaOH中和生成NaAlO2和H2O。Al(OH)3是典型的两性氢氧化物,它的酸性和碱性都很弱。
两性氢氧化物表现酸性时,可写成酸的形式,例如H3AlO3、H2ZnO2。一些非金属氢氧化物以酸性为主,一般写酸的形式,例如亚砷酸(H3AsO3)。
【络合物】含有络离子的一类复杂化合物,例如冰晶石Na3[AlF6]、硫酸四氨合铜(II)[Cu(NH3)4]SO4、氢氧化二氨合银[Ag(NH3)2]OH等。上述络合物的化学式中,用方括号括起的部分叫络离子,是络合物的内界,方括号以外的部分是络合物的外界。络离子是由中心离子(或原子)和配位体以配位键结合而成。常见的中心离子是过渡元素离子如Fe2+、Fe3+、Cu2+、Ag+、Hg2+等;常见的配位体有F-、Cl-、Cn-、SCN-离子和NH3·H2O等分子。它们之间容易形成络离子如[Fe(SCN)]2+、[Ag(NH3)2]+、[Cu(H2O)4]2+等。络合物的内界与外界以离子键结合,络合物溶于水时,完全电离产生络离子:[Ag(NH3)2]OH [Ag(NH3)2]++2OH-
[Ag(NH3)2]++2OH-
络离子比较稳定,在水溶液中部分电离。
[Ag(NH3)2]+ Ag++2NH3
Ag++2NH3
络合物普遍存在。例如人体中的血红素是Fe3+的络合物,植物体内的叶绿素是Mg2+的络合物。络合物广泛应用于工农业生产和科学技术,例如金的提取、电镀、照相技术,离子的鉴定和测定等。络合物,现称为配位化合物,简称配合物。
【同素异形体】(亦称同素异性体)同种元素组成的不同单质,例如石墨和金刚石、氧气和臭氧、白磷和红磷等。同素异形体的分子组成或晶体结构不同,它们的物理性质和化学性质有明显的区别,
例如金刚石是由碳原子以共价键连接形成的正四面体空间网状结构的原子晶体;石墨是一种层状结构的过渡型晶体,层内碳 原子以共价键结合形成正六边形网状结构,层与层之间距离较大,相当于分子间力的作用。金刚石是硬度最大的物质,不能导电;而石墨的硬度较小,层之间可以相 对滑动,导电性好,化学性质较金刚石活泼。
又如白磷和红磷,白磷是由正四面体结构的分子(P4)组成,为白色腊状固体,有剧毒,易溶于CS2,着火点低(40℃),在空气中可自燃;红磷是较复杂的层状晶体,红色粉末,无毒,不溶于CS2,着火点240℃。隔绝空气加热温度升至260℃时,白磷转变成红磷,红磷受热在416℃时先升华,蒸气冷却又变为白磷。
O2和O3的分子组成不同,O3是较O2更活泼的氧化剂。
【定义】在氧化-还原反应中得到电子(或电子对偏近)的反应物。在反应中氧化剂中元素的化合价(或氧化数)降低。氧化剂能氧化其它物质而自身被还原,例如:Cl2是氧化剂,在反应中获得电子,化合价(或氧化数)降低,将FeCl2氧化成FeCl3而Cl2自身被还原成Cl-。
【说明】
1.氧化剂能氧化其他物质而自身被还原。它得到电子后,自身的化合价(或氧化数)降低。
2.氧化剂通常是指容易获得电子的物质,常见的有:
(1)活泼的非金属单质、如氧、氯、溴等。
(2)具有高化合价(氧化数)的金属离子,如Fe3+ 、Sn4+ 等。
(3)含有高化合价(氧化数)元素的含氧化合物,如KMnO4、K2Cr2O7、MnO2、KClO3、HNO3、H2SO4(浓)、PbO2等。
(4)过氧化物,如H2O2、Na2O2、BaO2等。
3. 一种物质是氧化剂还是还原剂不能绝对化。因为同一种物质在一个反应中作氧化剂,在另一反应 中可以作还原剂。
4. 氧化剂氧化能力的大小可以根据它的氧化态和还原态所组成的电对--标准电极电势(伏)的大小来判断。E°(伏)的值越大(或越正),表明该氧化剂的氧化能力越强,或者说该物质的氧化态是越强的氧化剂。
【定义】一种物质被氧化,同时另一种物质被还原的化学反应。人们对它的认识分为三个阶段:①有得失氧的反应②有化合价升降的反应③有电子转移(包括电子得失和共用电子对偏移)的反应。第一种认识仅限于有氧参加的反应;而氧化还原反应的本质是电子转移,表面特征是元素化合价有升降。物质失电子的反应叫做氧化反应,表现为所含元素化合价升高;物质得电子的反应叫做还原反应,表现为所含元素化合价降低。在有机化学中,将有机物得氧或失氢称为被氧化,得氢或失氧称做被还原。
【说明】
1、氧化还原反应的分类方法有:
①按元素间的作用分为不同物质中不同元素间的氧化还原、不同物质中同种元素不同价态间的氧化还原、同种物质中不同元素间的氧化还原、同种物质中同种元素的自身氧化还原等。
②按反应微粒可分为分子与分子、分子与原子、分子与离子、原子与原子、原子与离子、离子与离子等类的氧化还原。
氧化还原反应与化学反应四种基本类型之间的关系是:置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应,化合或分解反应不一定是氧化还原反应。
2、 反应物的原子或离子,在反应中改变氧化数(或化合价), 这是氧化还原反应的特征。
3、在氧化还原反应中,氧化和还原必然同时发生,有物质失去电子,必有物质得到电子,并且得失的电子数相等(或氧化数、化合价升降数分别相等)。
4、 分子内的氧化还原反应会发生在分子内部不同元素原子之间。也可以发生在分子内同种元素原子之间。 这类反应又叫岐化反应。
5、有的氧化还原反应有多种氧化剂、还原剂参加,即有多种元素原子的氧化数升高(或降低)。
在反应中,物质具有得电子的性质叫做氧化性,该物质为氧化剂;物质具有失电子的性质叫做还原性,该物质为还原剂。物质氧化性或还原性的强弱由得失电子难易决定,与得失电子多少无关。
比较不同物质氧化性或还原性的强弱,主要有以下方法:
①比较不同的氧化剂(或还原剂)跟同一还原剂(或氧化剂)反应时,所需条件及反应的剧烈程度。例如,钠与水常温下剧烈反应生成氢气,镁与冷水不易反应,加热时也能生成氢气,但较缓慢,说明钠比镁的还原性强。
②“强强制弱弱”原理,即较强的氧化剂和还原剂反应,生成较弱的氧化剂和还原剂。
③比较不同的氧化剂(或还原剂)将同一还原剂(或氧化剂)氧化(或还原)的程度。例如,Cl2可把Fe氧化为+3价,S只能把Fe氧化成+2价,说明Cl2比S的氧化性强;再如,HI可把浓H2SO4还原成H2S,HBr只能将浓H2SO4还原成SO2,说明HI比HBr的还原性强。注意,氧化性或还原性的强弱不能由自身的变化决定,例如,浓HNO3做氧化剂时,氮一般由+5变为+4价,稀HNO3做氧化剂时,氮一般由+5变为+2价,不能说稀HNO3比浓HNO3氧化性强。此外,物质的氧化性或还原性还与外界条件、浓度等因素有关,一般情况温度升高或浓度加大,物质的氧化性或还原性增强。
在氧化还原反应中,氧化剂得电子,表现为所含元素化合价降低;还原剂失电子,表现为所含元素化合价升高;得失电子数与化合价升降数相等。因此,电子转移的方向和数目可通过元素化合价的变化判断。在反应中,某元素电子得失总数等于该元素一个原子化合价升降数乘以方程式系数。主要表示方法有两种:①表示同一元素反应前后电子转移情况时,分别将氧化剂与其产物、还原剂与其产物中相应的变价元素用直线连接起来,箭头从反应物指向产物,线上标出得失电子总数,称为“双线桥法”。
②表示氧化剂和还原剂之间不同元素的电子转移情况时,将氧化剂中降价元素与还原剂中升价元素用直线连接起来,箭头从还原剂指向氧化剂,线上标出电子转移总数,称为“单线桥法”。
例如,铁与氯气的反应。
双线桥法:
单线桥法:
通常情况用单线桥法表示比较简单,且易判断出氧化剂和还原剂(箭头所指为氧化剂)。在同种元素发生自身氧化还原反应时,用双线桥法表示比较明确,例如,过氧化钠跟水反应。
【歧化反应】也称自身氧化-还原反应。是氧化-还原反应的一种类型。在歧化反应中,同一种元素的一部分原子(或离子)被氧化,另一部分原子(或离子)被还原。这是由于该元素具有高低不同的氧化态,在适宜的条件下向较高和较低的氧化态转化的缘故。例如:
【置换反应】化学反应的基本类型之一,是一种单质跟一种化合物反应生成另一种单质和另一种化合物的反应。例如:
2Na+2H2O=2NaOH+H2↑
Fe+CuSO4=FeSO4+Cu
Cl2+2KI=2KCl+I2
在置换反应中,反应前后某些元素的化合价必定改变,因此置换反应都属于氧化-还原反应。置换反应中,按化学活动性顺序,较活动的金属能跟酸或盐反应,置换出较不活动的金属和氢气;较活动的非金属能与盐反应,置换出较不活动的非金属。
【化合反应】化学反应的基本类型之一,是两种或两种以上的物质生成另一种物质的反应。例如: 化合反应
在化合反应中,如果反应前后各元素的化合价保持不变,就属于非氧化-还原反应,如氧化钙与水化合;如果元素的化合价发生改变,就属于氧化-还原反应,如镁条在空气中燃烧。在化合反应中,反应物越活泼,生成物就越稳定,反应就越容易进行。
【分解反应】化学反应的基本类型之一。是一种物质生成两种或两种以上物质的反应。例如:
在分解反应中,如果反应前后各元素的化合价保持不变,就属于非氧化-还原反应,如NaHCO3受热分解;如果有些元素的化合价发生改变,就属于氧化-还原反应,如电解水的反应。
【重铬酸钾】化学式K2Cr2O7,式量294.18。别名红矾钾。红色单斜或三斜有光泽的晶体。密度2.676克/厘米3 ,熔点398℃,溶于水,水溶液显酸性,不溶于乙醇。
500℃分解,生成铬酸钾和三氧化二铬。有强氧化性,是重要的氧化剂。跟有机物接触摩擦或撞击能燃烧或爆炸。在冷溶液中可以氧化硫化氢、亚硫酸、碘化氢和亚铁离子等。加热时可氧化盐酸、氢溴酸,在这些反应中重铬酸钾被还原成三价铬离子。
饱和的重铬酸钾溶液和浓硫酸的混合物叫做铬酸洗液,实验室中用于洗涤化学玻璃器皿。用它做基准试剂、氧化剂、氧化还原滴定剂、微量分析中测定氯的含量,制颜料,还应用于有机合成、鞣革、电镀等。重铬酸钠跟硫酸钾或氯化钾溶液混合反应后分步结晶,可制得本品。
【重铬酸盐】
重铬酸盐在酸性溶液中是强氧化剂。例如,在冷溶液中K2Cr2O7可以氧化H2S,H2SO3和HI;加热时,可氧化HBr和HCl。在这些反应中,Cr2O72- 的还原产物都是Cr3+ 的盐。
Cr2O72- + 6I- + 14H+ ![]() 2Cr3+ + 3I2 + 7H2O
2Cr3+ + 3I2 + 7H2O
Cr2O72- + 3SO32- + 8H+ ![]() 2Cr3+ + 3SO42- + 4H2O
2Cr3+ + 3SO42- + 4H2O
在分析化学中,常用K2Cr2O7来测定铁:
K2Cr2O7 + 6FeSO4 + 7H2SO4![]() 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
实验室中所用的洗液,它是重铬酸钾饱和溶液和浓硫酸的混合物(往5gK2Cr2O7配制的热溶液中加入100ml浓H2SO4)叫铬酸洗液,有强氧化性,可用来洗涤化学玻璃器皿,以除去器壁上沾附的油脂层。洗液经使用后,棕红色逐渐转变成暗绿色。若全部变成暗绿色,说明Cr(Ⅵ)已转化成为Cr(Ⅲ),洗液已失效。
重铬酸钾也可被乙醇还原,利用该反应可监测司机是否酒后驾驶。
3CH3CH2OH+2K2Cr2O7+8H2SO4![]() 3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O
3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O
重铬酸钠和重铬酸钾均为大粒的橙红色晶体。在所有的重铬酸盐中,以钾盐在低温下的溶解度最低,而且这个盐不含结晶水,可以通过重结晶法制得极纯的盐,用作基准的氧化试剂。
【铬酸钾】化学式K2CrO4,式量194.20。黄色斜方晶体,密度2.732克/厘米3,熔点968.3℃。溶于水成深黄色溶液,溶液中性,不溶于酒精及乙醚中。性毒。
有氧化性。水溶液中加入硫酸后溶液变成橙红色,这是由于生成了重铬酸钾的原故 ,2K2CrO4+H2SO4 =K2CrO7+K2SO4 +H2O ;铬酸钾加热变成红色,冷却后又重新变为黄色。
用做氧化剂,媒染剂和金属防锈剂。还用于银、钡等的微量分析、鞣革、制药等。把磨细的铬铁矿跟氢氧化钾、石灰石一起煅烧后,再加入硫酸钾溶液,便可制得铬酸钾。
【硫代硫酸钠】俗名海波或大苏打。化学式Na2S2O3·5H2O,式量248.18。无色透明,单斜晶体,密度1.729克/厘米3,在33℃以上的干燥空气里风化。易溶于水,水溶液呈弱碱性,不溶于乙醇。56℃时溶于结晶水中,100℃时失水,灼烧时分解为硫化钠及硫酸钠,跟强酸反应析出硫并放出二氧化硫。Na2S2O3+H2SO4 =Na2SO4 +S↓+SO2↑+H2O ;其水溶液可溶解溴化银或氯化银。AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr 。因此,可用做照像的定影剂。海波有还原性,可用做去氯剂、媒染剂,还常用做分析试剂,如氧化-还原滴定剂。用亚硫酸钠溶液跟硫共煮后过滤、蒸发、结晶即得硫代硫酸钠晶体。
硫代硫酸钠在中性、碱性溶液中很稳定,在酸性溶液中迅速分解。
Na2S2O3 + 2HCl ![]() 2NaCl + S↓ + SO2↑ + H2O
2NaCl + S↓ + SO2↑ + H2O
硫代硫酸钠是一种中等强度的还原剂,与碘反应时,它被氧化为连四硫酸钠;与氯、溴等反应时被氧化为硫酸盐。因此,硫代硫酸钠可做为脱氯剂。
2Na2S2O3 + I2![]() Na2S4O6 + 2NaI
Na2S4O6 + 2NaI
Na2S2O3 + 4Cl2 + 5H2O ![]() 2H2SO4 + 2NaCl + 6HCl
2H2SO4 + 2NaCl + 6HCl
硫代硫酸根有很强的配位能力
2S2O32- + Ag+ ![]() [Ag(S2O3)2]3-
[Ag(S2O3)2]3-
照相底片上未曝光的溴化银在定影液中即由于形成这个配离子而溶解。
 |
| 重过磷酸钙 |
【熟石膏】主要成分CaSO4·H2O,白色粉状固体。由生石膏CaSO4·2H2O,在150℃时脱水生成。熟石膏跟水混和成糊状逐渐硬化并膨胀,可用来制石膏塑像、模型、粉笔及医用石膏绷带等。
【石膏】又称生石膏,主要成分是CaSO4·2H2O。常见的硫酸盐矿物。系无色、白色、灰色、淡黄色、粉红色、透明或半透明的单斜晶体。有玻璃光泽,常为块状,纤维状或片状,完全解理,质脆、密度2.32克/厘米3、硬度2.0,微溶于水。细粒致密块状的称为雪花石膏。128℃失3/2H2O,150℃脱水成熟石膏(CaSO4·H2O),加热到500℃以上成无水石膏。用于制造硫酸,水泥,熟石膏,还用作制油漆,纸张的填料,制豆腐的凝结剂。中医用它做清热药,性大寒,味辛甘,可治高烧、烦渴、肺热喘嗽和胃火牙痛等。
【发烟硫酸】化学式H2SO4 ·xSO3。将三氧化硫溶解在浓硫酸中所形成的溶液称为发烟硫酸。无色油状液体。其密度、熔点、沸点随着三氧化硫的含量不同而改变。通常以游离SO3的含量未标明不同浓度的发烟硫酸,如40%发烟硫酸即表示在发烟硫酸中含有40%游离的SO3。一般使用的有20%发烟硫酸,密度为1.9克/厘米3,熔点-11℃,沸点166.6℃。发烟硫酸暴露在空气中,挥发出来的SO3,和空气中的水蒸气形成硫酸细小液滴而“发烟”。有吸水性、腐蚀性、脱水性,强氧化性。用作硝酸脱水剂、有机合成的磺化剂、有机硝化反应中的脱水剂。还用于精炼石油。
 |
| 发烟硫酸 |
单质磷有几种同素异形体,其中白磷或黄磷是白色或淡黄色腊状晶体,是由P4分子组成的分子晶体,P4分子是四面体构型。密度1.82克/厘米3,熔点44.1℃,沸点280℃,着火点40℃,有蒜臭气味,有剧毒,致死量为60~100毫克。难溶于水,易溶于二硫化碳,在气态和溶液中以P4形式存在。
白磷在潮湿空气中缓慢氧化,部分反应的能量以光能的形式释放出来,故在暗处可看到磷光。白磷在空气中经缓慢氧化,积蓄热量使温度达到着火点,引起自燃。白磷隔绝空气加热到400℃数小时可转化为红磷。
红磷是暗红色粉末,是磷的一种稳定变体,无定形体。密度2.2克/厘米3,不溶于水和二硫化碳等一般溶剂,熔点590°(4355.9千帕——43大气压),沸点200℃,着火点240℃。无毒。在416℃时红磷升华,它的蒸气冷却后变成白磷。在1.2×109千帕(12000大气压)和200℃时,白磷可转变成一种黑色同素异形体——黑磷,它有石墨状片层结构,呈铁灰色,有金属光泽,能导电,密度2.25~2.69克/厘米3,燃点490℃。白磷化性活动,红磷次之,黑磷化学活动性最差。磷的各种单质都能燃烧生成五氧化二磷;白磷、红磷都易与卤素化合,生成三卤化磷或五卤化磷。
白磷溶于热浓碱液中生成磷化氢和次磷酸盐,如:P4+3KOH+3H2O=PH3↑+3KH2PO2 ,
白磷可跟金、银、铜、铅盐溶液反应。
如:2P+5CuSO4+8H2O=5Cu+2H3PO4+5H2SO4 ;11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4
白磷用于制磷酸、烟雾弹、杀鼠药等。红磷用于制火柴和农药等。1669年德国的布兰特从人尿蒸馏和干馏后的物质中制得白磷。自然界中磷以磷酸盐的形式存在,主要矿石有磷灰石。磷也构成生物体的重要元素,存在于细胞、骨骼、蛋白质中。工业上将磷酸钙、二氧化硅和焦炭混和在电炉中反应制得白磷。
银白色或微红色有金属光泽的晶体,熔点271.4℃,沸点1560±5℃,蒸气分子中单原子分子和双原子分子处于平衡状态。主要氧化数-3、+1、+3、+5。质脆而硬,凝固时体积膨胀,膨胀率为3.3%。密度9.747克/厘米3。
常温下在干燥空气中稳定,在潮湿空气中可被氧化。红热时燃烧呈蓝色火焰,生成黄色氧化物Bi2O3。常温下不跟水反应,红热时能被水蒸气缓慢氧化。铋粉可在氯气中自燃,加热时跟溴、碘、硫、硒直接化合生成三价化合物。不溶于稀盐酸和稀硫酸,溶于硝酸和浓硫酸生成三价铋盐。
1753年英吉甫鲁瓦发现了铋。自然界中有游离态和化合态两种形式。主要矿物有辉铋矿、铋华等。在地壳中的丰度为2.0×10-5%。主要用于制低熔点合金(熔点在45℃以上100℃以下),在消防和电气工业上用作自动灭火装置和保险丝及焊锡。还用于制活字合金、医药等。由煅烧辉铋矿得三氧化二铋,再与碳共热还原得到铋。
锑有几种同素异形体。通常最稳定的是灰锑,银白或银灰色菱形晶体,脆而硬,由液态凝固时体积膨胀,即有冷胀性,密度6.68克/厘米3,熔点 630.74℃,沸点1750℃,锑蒸气分子为Sb4,导电性差。此外还有灰色的无定形锑,黄色的黄锑,黑色的黑锑等。
锑化学性质不很活动。室温下不能被空气中氧气氧化,但能跟氟、氯、溴化合生成三价或五价卤化物。加热时可跟碘、硫化合。高温时燃烧显蓝色并生成Sb4O6。常温时不跟水反应,红热时跟水反应放出氢气。跟热硝酸反应,生成水合氧化锑:6Sb+10HNO3+3xH2O=3Sb2O5·xH2O+10NO↑+5H2O ,能溶于热的浓盐酸和硫酸生成氯化锑和硫酸锑。与强碱反应生成亚锑酸盐,主要用于制合金如印刷用的活字合金、硬质合金、巴氏合金。还用于制锑盐、医药、颜料及半导体材料等。古代已应用锑及其化合物。在自然界中有游离态和化合态两种形式存在,主要矿物有辉锑矿(Sb2S3)和方锑矿(Sb2O3)。
在地壳中的丰度为1.0×10-4%。用辉锑矿跟铁屑共热,或用三氧化二锑与碳共热都可还原出锑。
【雌黄】矿物名。化学成分为As2S3。单斜晶系,晶体常呈柱状。集合体呈短柱状,板状。柠檬黄色,有时微带浅褐色。有金刚光泽或珍珠光泽。质脆,解理完全。灼烧后发出强烈的蒜臭。用于提取三氧化二砷,制造玻璃、颜料等。
【雄黄】矿物名。化学成分为AsS,也称鸡冠石。单斜晶系,晶体为柱状,大多成块状集合体。多数为桔红色。半透明,晶面有金刚光泽。密度3.5克/厘米3。难溶于水。质脆,有毒。用于提炼砷,制取三氧化二砷。还用于制颜料、玻璃、焰火。中医药用为解毒、杀虫药,外用治癣疥恶疮、蛇虫咬伤;内服微量治惊痫、疮毒等。
【砒霜】别名亚砷酸酐,俗称砒霜,化学式As2O3,式量197.84。白色粉末,微溶于水。两性氧化物,溶于盐酸生成三氯化砷,溶于氢氧化钠和碳酸钠溶液生成亚砷酸钠。约193℃升华,剧毒,致死量约0.06克。用于制亚砷酸盐、医药、防腐剂。由砷燃烧制得。
俗名砒。有三种同素异形体:黄色的α体、黑色的β体和灰色的γ体。室温下最稳定的是γ体,有明显的金属性质,硬而脆,密度 5.73克/厘米3,熔点817℃(2836.4千帕——28大气压),613℃升华。气态分子组成为As4(800℃)。
游离态砷化性很活泼,在空气中加热至200℃时有荧光出现,在400℃时燃烧呈蓝色火焰,并形成白色的氧化砷烟(As4O6),易与氟、氮化合,在加热时也易和大多数金属和非金属化合。不溶于水。能被硝酸或浓硫酸氧化生成砷酸,如:3As+5HNO3+2H2O=3H3AsO4+5NO
跟熔融氢氧化钠反应生成亚砷酸钠Na3AsO3并放出氢气。能溶于王水。砷及其化合物都有毒。砷在自然界分布很广,主要以化合态存在,少量以游离态存在。在地壳里丰度为5.0×10-4%,重要矿物有毒砂FeAsS、雄黄As2S2、雌黄As2S3和白砷石As2O3等。1250年罗马的马格努斯用雄黄共热发现了砷。主要用途是与铅、铜、锌等制成合金,也用于制医药和杀虫剂以及半导体材料如砷化镓。由三氧化二砷跟碳反应制得。
【概述】化学式HN3,式量43.03。无色有刺激性气味的液体,沸点35.8℃,熔点-80℃。是易爆物质,受到撞击立即爆炸、分解。2HN3=3N2+H2,稀溶液几乎不分解。HN3为弱酸Ka=1.9×10-5 。用稀硫酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得: NaNH2+N2O=NaN3+H2O
【性质】
它是易爆物质,只要受到撞击就立即爆炸而分解。
2HN3![]() 3N2+H2 ;ΔrHθ =-593.6KJ·mol-1
3N2+H2 ;ΔrHθ =-593.6KJ·mol-1
因为HN3的挥发性高,可用稀H2SO4与NaN3作用制备HN3:
NaN3+H2SO4![]() NaHSO4+HN3
NaHSO4+HN3
NaN3可从下面反应得到:
3NaNH2+NaNO3![]() NaN3+3NaOH + NH3
NaN3+3NaOH + NH3
HN3的水溶液为一元弱酸(K=1.9×10-5 ),它与碱或活泼金属作用生成叠氮化物。
HN3+NaOH![]() NaN3+H2O
NaN3+H2O
2HN3+Zn![]() Zn(N3)2+H2
Zn(N3)2+H2
HN3中N的氧化态为-1/3,所以它既显氧化性又显还原性。HN3的水溶液会发生歧化分解。
HN3+H2O![]() NH2OH + N2
NH2OH + N2
活泼金属如碱金属和钡等的叠氮化物,加热时不爆炸,分解为氮和金属。
2NaN3(s)![]() 2Na(l) + 3N2(g)
2Na(l) + 3N2(g)
加热LiN3则转变为氮化物。象Ag、Cu、Pb、Hg等的叠氮化物加热就发生爆炸,基于这一性质,Pb(N3)2和Hg(N3)2可做为雷管的起爆剂。
【概述】
别名肼,化学式NH2—NH2。无色油状液体,与水、乙醇互溶。熔点2℃,沸点113.5℃,有氨的气味,剧毒。联氨可看做是氨分子内的一个氢原子被氨基取代的衍生物。有碱性,可与无机酸反应生成盐。在水溶液中既显氧化性又显还原性。在酸性溶液中是强氧化剂。在强碱性溶液中是强还原剂。有强腐蚀性,可腐蚀玻璃、橡胶、软木等。有可燃性:N2H4(液)+O2(气)=N2(气)+2H2O(液);ΔH=-624千焦/摩尔 ,用作火箭燃料,医药原料,也常用作还原剂、显影剂。
【结构】
联氨
【性质】
1、纯联氨是一种可燃性的液体,它在空气中发烟,能与水及酒精无限混合。在加热时联氨便发生爆炸性的分解。它在空气中燃烧放出大量的热。它的烷基衍生物可作为火箭的燃料。
N2H4(l)+O2(g) N2(g)+2H2O(1) ΔrHθ =-624KJ·mol-1
N2(g)+2H2O(1) ΔrHθ =-624KJ·mol-1
2、联氨可以接受两个质子而显碱性,是二元弱碱,碱性稍弱于氨。
N2H4+H2O N2H5+ +OH- K1=1.0×10-6 (298K)
N2H5+ +OH- K1=1.0×10-6 (298K)
N2H5+ +H2O N2H62+ +OH- K2=9.0×10-16 (298K)
N2H62+ +OH- K2=9.0×10-16 (298K)
它生成的两类盐中,一价酸根的盐如N2H5Cl较稳定,而N2H62+ 离子所生成的盐均易水解.
3、联氨是一种强还原剂,在碱性溶液中能将CuO、IO3- 、Cl2、Br2等还原,本身被氧化为N2。
4CuO+N2H4=2Cu2O+N2+2H2O
2IO3- +3N2H4=2I- +3N2+6H2O
随着参加反应的氧化剂不同,N2H4的氧化产物除了N2,还有NH4+ 和HN3。
2MnO4- +10N2H5+ +6H+ =10NH4+ +5N2+2Mn2+ +8H2O
N2H5+ +HNO2=HN3+H+ +2H2O
【制取】
先用氯跟稀氨水反应制得氯氨NH2Cl,然后加过量氨即得联氨。
2NH3+Cl=NH2Cl
2NH3+NH2Cl=N2H4+NH4Cl
【亚硝酸】化学式HNO2,式量47.02。是三价氮的含氧酸,酸酐为三氧化二氮。亚硝酸仅存在于稀溶液中,溶液显微蓝色。很不稳定,受热即分解为NO2、NO和H2O。是弱酸(略强于醋酸)。既有氧化性又有还原性。用于有机合成中伯胺的重氮化反应。可将等摩尔的NO2和NO混和物通入冷水中制得。工业上用亚硝酸钠跟盐酸反应制得。
当将等物质的量的NO和NO2混合物溶解在冰水中或向亚硝酸盐的冷溶液中加酸时,生成亚硝酸:
NO + NO2 + H2O ![]() 2HNO2
2HNO2
NaN02 + H2SO4![]() HNO2 + NaHSO4
HNO2 + NaHSO4
亚硝酸很不稳定,仅存在于冷的稀溶液中,微热甚至冷时便分解为NO、NO2和H2O。
亚硝酸是一种弱酸,但比醋酸略强。
HNO2 ![]() H+ + NO2- Ka=5×10-4 (291K)
H+ + NO2- Ka=5×10-4 (291K)
在亚硝酸中,N的氧化数为+Ⅲ,处于中间状态,因此,它既可作氧化剂又可作还原剂,其氧化性比稀硝酸还强。无论在酸性还是碱性介质中,其氧化性都大于还原性,即亚硝酸的氧化性是主要的。
【氮气】无色无味气体,标准状况下密度1.2506克/升,液氮0.8081克/厘米3。沸点-195.8℃,熔点-209.86℃,难液化在水里溶解度很小,20℃时1体积水仅溶解0.0155体积N2。空气溶入水的O2比N2多,升温使溶于水的空气逸出其含氧量高于普通空气。
氮元素是相当强的非金属,次于氟、氧、氯居第四位。N2分子中N≡N键能很大,达949千焦/摩,不易解离为原子,而表现出稳定性和化学惰性。高温或放电条件下分子中化学键破坏而能与多种元素反应。如与H2生成NH3;与Mg、Ca、Sr、Ba生成氮化物Mg3N2、Ca3N2等;与O2在电弧高温下少量反应生成NO,此反应吸热是O2与其它物质化合时所罕见的。对碱金属只易与锂化合成氮化锂Li3N,却不与其它碱金属直接反应。
主要用于合成氨以制化肥、硝酸、炸药、塑料等。N2不支持呼吸而用于保存粮食、水果,以减缓代谢,使害虫缺氧死亡。N2稳定而用做某些金属焊接时的保护气;于白炽灯内充入一定量Ar、N2混合气能防止钨丝氧化和减慢挥发。液氮可达-196℃低温,用做深度致冷剂,医疗上用液氮冻掉疣瘤,科研上也常用液氮致冷。
【氨气】无色气体,具特有的强烈刺激性气味。密度0.771克/升(标准状况),比空气轻。沸点-33.35℃,高于同族氢化物PH3、AsH3,易液化。熔点-77.7℃。液氨密度0.7253克/厘米3,气化热大,达23.35千焦/摩,是常用的致冷剂。极易溶于水,20℃时1体积水能溶解702体积NH3。充满NH3的烧瓶做喷泉实验后得到的稀氨水约为0.045摩/升。用水吸收NH3时要用“倒放漏斗”装置以防倒吸。液氨是极性分子,似水,可发生电离:

也能溶解一些无机盐如NH4NO3、AgI。空气中允许NH3最高含量规定为0.02毫克/升,若达0.5%则强烈刺激粘膜,引起眼睛和呼吸器官的症状。
氨气较为稳定,具碱性和弱还原性。常见反应如体现其碱性的加合,与水生成NH3·H2O,在溶液中有平衡关系:

属于NH3的孤对电子与H+空轨道形成配位键的加合。此外NH3的孤对电子与某些物质形成配位键而使氨水能溶解AgCl、AgBr、AgOH、Ag2O生成

HCl相遇出白烟(微粒NH4Cl),可彼此互验。氨的弱还原性表现于如对O2、

有:
4NH3+3O2(纯) 2N2+6H2O
2N2+6H2O

8NH3+3Cl2 N2+6NH4Cl
N2+6NH4Cl
氨气大量用于生产化肥:尿素CO(NH2)2、硫铵(NH4)2SO4,硝铵NH4NO3等。生产纯碱用NH3与NaCl、H2O和CO2反应,副产品是氯铵NH4Cl化肥。氨还用于生产合成材料如聚氨酯塑料、丁腈橡胶,粘合剂,染料和一些药品和医药。氨氧化法可生产硝酸用于制造炸药和染料。10%的氨水可用于减轻皮肤上蚊虫叮咬的伤痛,其刺激气味可用于使处于麻醉状态和昏厥状态的人苏醒。
N2+3H2 2NH3;ΔH<0
2NH3;ΔH<0
最适条件是以铁触媒为催化剂在高温、高压下反应,温度400~550℃,过高则化学平衡强烈向左移动,过低则反应速度过慢,降低单位时间氨产量,此温度也是催化剂活性最强的温度范围。压强高平衡右移有利于NH3的生成,但过高则给设备和技术条件造成困难,常以150~300兆帕为宜,过低则平衡右移微弱致使NH3产量降低。工业上以空气、水、煤、天然气、石化产品等首先制得N2、H2,经严格提纯(防止催化剂中毒),给N2:H2=1:3(体积)的混合气体施以高压,通入装有铁触媒的合成塔,在高压和400~550℃条件下反应,仅有部分N2、H2合成NH3。再导出冷却分离出NH3后将未反应的N2、H2循环使用,以提高原料利用率降低成本。若以焦炭、水、空气为原料时,理论上用于计算的关系式为3C~4NH3。
【硝酸】无色液体,密度1.5027克/厘米3,熔点—42℃,沸点83℃,不断挥发出的蒸气有毒性和腐蚀性气味,易溶于水,属于挥发酸。常用者为68%溶液,无色,密度1.41克/厘米3,约相当于15摩/升。沸点120.5℃。93%HNO3因溶入NO2而呈黄至棕黄色,开盖则逸出棕色浓雾,叫发烟硝酸。应密闭保存于棕色玻璃塞瓶中,不可用无色试剂瓶和橡皮塞,以防见光分解,挥发和腐蚀橡皮。
HNO3具强酸性,强氧化性,浓硝酸能与除Au、Pt、Ta、Rh、Ir等很不活动金属外的所有金属反应。与冷浓HNO3呈钝态的金属有Fe、Al、Cr;生成可溶性硝酸盐与NO2。(有时杂有NO)的有Cu、Ag、Hg等;生成含氧酸或氧化物的有Sn、Sb、W、Mo等。对非金属可把C、S、P氧化为CO、H2SO4、H3PO4。稀硝酸氧化性比浓硝酸弱。因浓度不同还原产物可出现NO、N2O、铵盐等。个别杂有H2。实际上还原产物是不单一的,只是以某种为主,如6~8摩/升HNO3还原产物以NO为主。
硝酸不能与HI、H2S、HBr、Fe2+、SO2、亚硫酸盐等有明显还原性物质共存,因条件不同可将它们氧化为I2或HIO3、S或H2SO4、Br2、Fe 3+ 、H2SO4、硫酸盐等。
在光、热条件下分解,也能与木屑、碎布等可燃性有机物反应甚至燃烧,或自燃。保存时应使用棕色玻璃寒瓶,远离火源和叮燃有机物。浓硝酸与浓盐酸以体积比1:3混合而成“王水”能溶解Au、Pt等,王水不稳定,要现用现配。
历史上曾用智利硝石与浓硫酸共热制取。现改用氨氧化法制取,其法以氨和空气为原料,用Pt—Rh合金网为催化剂在氧化炉中于800℃进行氧化反应,生成的NO在冷却时与O2生NO2,NO2在吸收塔内用水吸收在过量空气中O2的作用下转化为硝酸,最高浓度可达50%。制浓硝酸则把50%HNO3与Mg(NO3)2或浓H2SO4蒸馏而得。主要生产阶段的反应为:

4NO+2O2 4NO2
4NO2
4NO2+O2+2H2O 4HNO3(即有O2时,计算时关系式为NH3~HNO3。)
4HNO3(即有O2时,计算时关系式为NH3~HNO3。)
硝酸厂尾气中氮的氧化物>0.4%(体积)需用碱液吸收制成NaNO2:NO+NO2+NaOH NaNO2+H2O,否则,严重污染大气。
NaNO2+H2O,否则,严重污染大气。
 N2O4;ΔH<0,冷却或加压则平衡右移。常温时NO2中有一定量N2O4,而使实测的分子量比由NO2分子式算出的数值稍大。具氧化性,能与热铜反应生成N2与CuO,也能使KI—淀粉湿试纸变蓝,对橡胶腐蚀严重。
N2O4;ΔH<0,冷却或加压则平衡右移。常温时NO2中有一定量N2O4,而使实测的分子量比由NO2分子式算出的数值稍大。具氧化性,能与热铜反应生成N2与CuO,也能使KI—淀粉湿试纸变蓝,对橡胶腐蚀严重。【概述】
皆为易溶于水的晶体,结晶水合物的颜色由阳离子而定,一般皆易溶于水。
常温下除AgNO3等少数见光易分解外,其它都较稳定。其热分解产物与阳离子有关,可大致参照金属活动性分为:
Mg以前金属硝酸盐热分解成亚硝酸盐与O2;
Mg~Cu间金属硝酸盐热分解产物为氧化物、O2与NO2;
位于Cu以后的产物则为单质、NO2、O2。
特殊情况如LiNO3分解为Li2O等而不是LiNO2,Mn(NO3)2分解为MnO2、NO2不产生O2。
加热时硝酸盐中+5价的N氧化性显著,如黑火药中的KNO3为氧化剂,在点燃时与C、S反应而爆发。
在溶液里硝酸盐的氧化性随加酸而增强,如FeSO4与KNO3混合并不氧化Fe2+ ,但加硫酸,则很快反应生成Fe3+ 使溶液变黄。初步检验硝酸盐的方法是,将待测液蒸发浓缩,加铜与浓硫酸共热若有棕红色NO2气体产生,则原溶液中有硝酸根离子。
【性质】
硝酸盐大多是无色易溶于水的晶体,它的水溶液没有氧化性。硝酸盐在常温下是较稳定的,但在高温时固体硝酸盐会分解放出02而显氧化性。硝酸盐热分解的产物决定于盐的阳离子。碱金属和碱土金属的硝酸盐热分解放出O2并生成相应的亚硝酸盐。电位顺序在Mg和Cu之间的金属所形成的硝酸盐热分解时生成相应的氧化物。电位顺序在铜以后的金属硝酸盐则分解为金属,例如;
2NaNO3![]() 2NaNO2+O2
2NaNO2+O2
2Pb(NO3)2![]() 2PbO + 4NO2+O2
2PbO + 4NO2+O2
2AgNO3![]() 2Ag + 2NO2+O2
2Ag + 2NO2+O2
由于各种金属的亚硝酸盐和氧化物稳定性不同,所以加热分解的最后产物也不同。
【概述】NaNO2,苍黄色或无色至白色晶体,熔点271℃,在320℃分解。极易溶于水,难溶于乙醇、乙醚。在空气中逐渐吸收O2而转化为NaNO3。所以要密闭保存。有毒性,施工防冻用“工业盐”主要成分是NaNO2,要严格与食盐区别以防中毒。NaNO2中的氮呈+3价,属于中间价态,其溶液遇酸化的碘化钾淀粉则变蓝,说明亚硝酸根离子有氧化性;酸性高锰酸钾溶液遇到NaNO2则紫色褪去,说明NaNO2有还原性。NaNO2主要用于防锈剂,化工原料和腌肉制品的添加剂。工业上可用铅与NaNO3共热制取,也来自硝酸厂尾气处理(NO2+NO+2NaOH==NaNO2+H2O)的副产品。宜防潮密封保存。有强氧化性。跟硫、磷、有机物等摩擦或撞击可引起燃烧或爆炸。用做微量分析试剂、氧化剂、重氮化试剂、亚硝酸盐或亚硝基化合物的合成。大量用做防锈剂、印染、制取偶氮染料等。亚硝酸钠水溶液呈弱碱性,能从空气中吸取氧,使亚硝酸钠逐渐氧化成硝酸钠。
 |
| 亚硝酸钠 |
【亚硝酸盐】
除了浅黄色的微溶盐AgNO2外,一般亚硝酸盐易溶于水,水溶液是稳定的。亚硝酸盐,特别是碱金属和碱土金属的亚硝酸盐,都有很高的热稳定性。用粉末状金属铅、碳或铁在高温下还原固态硝酸盐,可得到亚硝酸盐,
Pb + KNO3![]() KNO2+PbO
KNO2+PbO
因亚硝酸盐中,氮原子的氧化态处于中间,因此既有氧化性又有还原性。亚硝酸盐在酸性溶液中是强氧化剂,氧化性是主要的;在碱性溶液中还原性是主要的,空气中的氧就能使NO2- 氧化为NO3- 。
例如,NO2- 在酸性溶液中能将I- 氧化为单质碘,
2NO2- + 2I- + 4H+ ![]() 2NO + I2+2H2O
2NO + I2+2H2O
这个反应可以定量地进行,能用于测定亚硝酸盐含量。用不同的还原剂,NO2- 可被还原成NO、N2O、·nH2OH、N2或NH3。当遇到更强氧化剂如KMnO4、Cl2等,亚硝酸盐则是还原剂,被氧化为硝酸盐,
2MnO4- + 5NO2- + 6H+ ![]() 2Mn2+ + 5NO3- + 3H2O
2Mn2+ + 5NO3- + 3H2O
Cl2+NO2- + H2O![]() 2H+ + 2Cl- + NO3-
2H+ + 2Cl- + NO3-
NO2- 离子是一种很好的配体,在氧原子和氮原子上都有孤电子对,它们能分别与金属离子形成配位键(如M←NO2和M←ONO),如NO2- 与钴盐能生成钴亚硝酸根配离子[CO(NO2)6]3- ,它与K+ 离子生成黄色K3[CO(NO2)6]沉淀,此方法可用于检出K+ 离子。

与碱性物质的NaOH、NH3等反应时,因碱量不同而生成正盐,一氢盐,二氢盐。
设na为H3PO4物质的量,nb为NaOH物质的量
则nb/na≤1,生成NaH2PO4,
1<nb/na<2,生成NaH2PO4与Na2HPO4混合物,
nb/na=2,生成Na2HPO4,
2<nb/na<3,生成NaH2PO4、Na3PO4混合物,
nb/na=3,生成Na3PO4。
上述反应另外产物为水。
磷酸主要用于钢管磷化、铝的阳极氧化、制取磷酸盐、生产青霉素时的酸碱度调节、食用酸性调味剂等。高纯磷酸用白磷燃烧产物P2O5与水反应制取,粗制品可用磷矿粉与硫酸反应制得。
 |
| 磷酸 |
【硫酸锌】化学式ZnSO4,是常见的一种硫酸盐。无色或白色晶体,受热时未到熔化即于600℃分解为ZnO与SO3,溶于水,常见的皓矾为七水合物ZnSO4·7H2O,无色晶体,易溶于水,280℃失水成无水物。
水溶液呈弱酸性(Zn2+水解)。与Na2S溶液产生向色沉淀ZnS;与少量NaOH溶液生成白色胶状Zn(OH)2沉淀,NaOH过量则溶为Na2ZnO2,是Zn(OH)2两性的体现之一。
若用新配制的BaS溶液与ZnSO4溶液以同摩尔浓度和等体积反应,则生成两种白色沉淀:ZnSO4+BaS=BaSO4↓+ZnS↓,摩尔比为1∶1,其遮盖力强即白色颜料锌钡白(立德粉),皓矾还用做媒染剂、收敛剂、补锌药剂、木材防腐剂等。【硫酸钙】化学式为CaSO4,无色晶体,熔点1450℃(单斜晶体), 微溶于水。
生石膏CaSO4· 2H2O是天然矿物,为白、浅黄、浅粉红至灰色的透明或半透明的板状或纤维状晶体。性脆,128℃失1.5H2O,163℃失2H2O。
工业上将生石膏热至150℃脱水成熟石膏(烧石膏)CaSO4·H2O,或(CaSO4)2·H2O,加水又转化为CaSO4·2H2O。据此可用于石膏绷带、制作石膏模型、粉笔、工艺品、建筑材料。
石膏还用为水泥调速剂以控制其硬化速度。油漆腻子、纸张填料也用到石膏,日常点豆腐可用它为凝结剂。农业上施用石膏以降低土壤的碱性。石膏矿与煤炭于高温可制得SO2用于生产硫酸。
CaSO4溶解度不大,其溶解度呈特殊的先升高后降低状况。如10℃溶解度为0.1928克/100克水(下同),40℃为0.2097,100℃降至0.1619,使溶解硫酸钙的硬水在高压锅炉(可达400℃)中结垢,造成危害, 应于事前Na2CO3使CaSO4转化为更难溶的CaCO3沉淀而除去(使硬水软化)。
在大理石遇稀H2SO4时因生成微溶CaSO4覆盖于大理石表面阻碍与酸的接触,使反应停止,故不能用稀H2SO4与大理石制取CO2。
【定义】由两种或几种不同的单质或化合物机械混合而成的物质,叫做混合物。
【说明】【定义】冶金工业上习惯把铁、铬、锰以及它们的合金(主要指合金钢 及钢铁)叫做黑色金属。实际上纯净的铁与铬都是银白色的,而锰是银灰色的。之所以把它们叫做黑色金属,是因为钢铁表面常覆 盖一层黑色的四氧化三铁,而锰和铬又主要应用于冶炼合金钢,所 以人们把铁、铬、锰以及它们的合金叫做黑色金属。另外,人们专门把这三种金属及其合金归成一类,而把其余所 有的金属及合金归成有色金属,这是因为钢铁在国民经济中占有极其重要的地位,是衡量一个国家国力的重要标志之一;它的产量 约占世界上金属总产量的95%。铬是所有金属中最硬的,又是难腐蚀的金属。人们常把铬接 进钢里,制成又硬又耐腐蚀的铬钢。铬钢是建造机械、枪炮筒、坦克和装甲、车等的好材料。在炼钢时掺人12%以上的铬,再掺进一定量的镍,可以炼成不锈钢。铬还是电镀时(俗称克罗米)的必用金属。在炼钢时掺人约13%的锰,可炼出坚硬、强軔的锰钢。人们用锰钢制造钢磨、滚珠轴承、推土机与掘土机的铲斗等易磨损部件。高锰钢还用来制造钢盔、坦克钢甲和穿甲弹的弹头等。近年来,大洋底下的锰结核引起人们的广泛兴趣。锰结核中 含锰高达50%,铁为27%。据估计,太平洋底约有1000亿吨猛结 核。我国是世界上取得锰结核开采资格的国家之一。新中国成立以后,我国的钢铁工业得到了飞速的发展,到 1993年为止我国的钢产量已超过8868万吨,是新中国成立以前 最高年产量(1943年90万吨)的近89倍,年产量已跃居为世界第二位。
【有色金属】除黑色金属以外的所有金属叫做有色金属。有色金属及其合金是现代材料的重要组成部分,它跟能源、信息技术关系密切,是发展国民经济,实现四个现代化必不可少的基础材料。据估计, 铜、铝、铅、锌、镍、锡、金和银8种有色金属的世界年产量仅为钢产量的5%,而其产值达到钢昀50%。
在冶金工业中,通常按密度的大小、矿物原料的富集程度以及 用途和价格,把有色金属分成轻金属、重金属、贵金属、半金属和稀有金属5大类。【重金属】它一般指密度大于4.5 g/cm3的金属,包括铜、铅、锌、镍、钴、 锡、锑、汞、镉、铋。如果把金属分成铁和非铁金属两大类,锰、铬也可归人重金属。
按冶金工业的有色金属分类法,密度大于4.5g/cm3的金属并不都归入重金属,如金、银、铂等归人贵金属,钨、钼、铌等归人稀有金属。【轻金属】它一般指密度小于4.5 g/cm3的金属,包括铝、镁、钠、钾、钙、 锶、钡。按冶金工业中有色金属的分类法,密度小于4.5 g/cm3的金属并不都归入轻金属,如锂、铷、铯、铍归入稀有金属(分属稀有轻金属),钛归入稀有金属中的难熔金属。
【贵金属】贵金属是有色金属中的一类,包括金、银和铂族金属(钼、钌、 铑、钯、锇、铱)共8种。这些金属在地壳里的丰度低,分布稀散,彼此互溶共生,富集、分离和提纯都较困难,价格较贵,所以得名为贵金属。
大量的银从冶炼铜、铅、锌的阳极泥中回收,金和铂族金属主 要从处理砂矿和矿脉中获得。我国的铂族金属主要从铜、镍、硫化共生矿中回收获得。
金、银常用来制造装饰品和钱币。从19世纪末开始,贵金属和贵金属合金应用于工业和科学研究,现广泛用于航空、航天、原子能、化工、电子工业、冶金工业等部门。【稀有金属】稀有金属通常指在地壳中含量较少或分布稀散的金属。它们 难以从原料中经济地提取,制取和使用得很少,因此得名为稀有金 属。近半个世纪以来,稀有金属的研究、生产和应用迅速发展,有 些稀有金属已经不“稀”,如钛在现代技术中的应用日益广泛、产量增多,所以有人也把它列人轻金属。
我国稀有金属资源丰富,例如,钨、钛、稀土、钒、锆、钽、铌、锂、 铍等已探明的储量都居于世界前列。我国内蒙的包头市境内稀土 储量占全国的97%,占世界储量的77%,是闻名世界的“稀土之 都”。包头稀土高新技术产业是国家级的,预计到本世纪末将成为全球最大的稀土工业之城。【不成盐氧化物】不能跟酸起反应,又不能跟碱起反应而生成盐和水,这类氧化 物叫做不成盐氧化物。例如,NO、CO属于不成盐氧化物。一氧化碳能跟氢氧化钠起反应,生成甲酸的钠盐。
CO+NaOH→HCOONa,但是在生成盐时没有生成水,所以一氧化碳仍属于不成盐氧化物。【定义】能跟碱起反应而生成盐和水,这种氧化物叫做酸性氧化物。
【说明】【定义】能跟酸起反应,生成盐和水,这种氧化物叫碱性氧化物。
【说明】【定义】能跟酸反应生成盐和水,又能跟碱反应生成盐和水,这种氧化物叫做两性氧化物。
【说明】【定义】由一定数量的配体(阴离子或分子)通过配位键结合于中心离子(或中性原子)周围而形成的跟原来组分性质不同的分子 或离子,叫做配合物。
【说明】【定义】
1. 它是带电的原子或原子团。
2. 它是由原子(包括原子团)或分子失去或得到电子后形成 的带电粒子。
【说明】
1. 原子失去电子后带正电荷,变成阳离子(或正离子);得到电子后带负电荷,变成阴离子(或负离子)。带电的原子团如高锰 酸根离子(Mn04-)、铜氨络离子{[Cu(NH3)2+}等,后者用定义2就难以说明。
2. 简单离子有三个重要特征,它们对离子的性质有决定性的影响。
(1) 离子电荷 简单离子所带的电荷数,就是该元素的化合价。例如,Fe-2e-→Fe2+ , Fe2+带2个单位正电荷,铁的化合价是+ 2。Fe2+有还原性,而Fe3+有氧化性。
(2) 离子半径 测定离子化合物的核间距,可以算出离子的半径,如rI-=216pm, rBr-=195pm。I-和Br-有相同的最外电子层结构,但因rI->rBr- ,I—容易失去电子,表现较强的还原性。
(3) 离子的电子层结构 离子的电子层结构有惰性气体构型 [如Na+ (2s22p6), F-(2s22p6) ]、18电子构型[如Zn2+ (3s23p6Sd10)、 Ag+ (4s24p64d10)]和不饱和构型[如 Pb2+ (6s2)、Fe2+ (3s23p63d6)] 三类
3. 离子一般存在于电解质溶液和离子化合物的熔融状态中。 在电弧、火焰或气体放电管中也能发现有简单离子或简单分子的离子。例如,在放电管或阴极射线中可以证明有H2+
【定义】含有结晶水的固体物质,叫做水合物(曾用名:结晶水合物)。
【说明】
1. 结晶水合物中的水分子是以确定量存在的,如FeCl3•6H20、FeS04•7H20、Ba(OH)2•8H20 和 ZnS04•7 H20等。 因此,结晶水合物是纯净物。
2. 水合物中的水分子有各种结合方式。一种是作为配位体, 配位在金属离子上,叫配位结晶水。另一种结合在阴离子上,叫阴离子结晶水。例如,CuSO4•5H20加热到113°C,只失去4分子水,加热到258°C才能脱去最后1分子水。由此推断,它的结构是 [Cu(H2O)4]2+ [SO4(H2O)]2- 。
【结构】
【性质】
纯羟氨是无色固体,熔点305K,不稳定,在288K以上便分解为NH3、N2和H2O
3NH2OH![]() NH3+ N2+ 3H2O
NH3+ N2+ 3H2O
4NH2OH![]() 2NH3+ N2O + 3H2O(部分按此式分解)
2NH3+ N2O + 3H2O(部分按此式分解)
羟氨易溶于水,它的水溶液比较稳定显弱碱性(比联氨还弱).
NH2OH + H2O![]() NH3OH+ + OH- K=6.6×10-9 (298K)
NH3OH+ + OH- K=6.6×10-9 (298K)
它与酸形成盐,常见的盐有[NH3OH]Cl和[NH3OH]2SO4。
将较高氧化态的含氮化合物还原,可制得羟氨,如把亚硝酸盐还原为羟氨的盐.
NH4NO2+ NH4HSO3+ SO2+ 2H2O![]() [NH3OH]+ HSO4- + (NH4)2SO4
[NH3OH]+ HSO4- + (NH4)2SO4
羟氨既有还原性又有氧化性,但它主要用作还原剂。羟氨与联氨作为还原剂的优点,一方面是它们具有强的还原性,另一方面是它们的氧化产物主要是气体(N2,N2O,NO),可以脱离反应体系,不会给反应体系带来杂质。
【一氧化二氮】俗称笑气。化学式N2O, 式量44.02。无色气体, 有微甜气味和微甜味道。密度1.977克/升, 熔点-90.8℃, 沸点-88.5℃。溶于水和乙醇, 但不与水反应。室温时不活动。加热至500℃以上分解为氮气和氧气。高温时跟碱金属及许多有机物反应。有麻醉作用, 吸入极少量时刺激面神经使人发笑。用作外科或牙科的麻醉剂及食物溶胶。用硝酸铵在熔融状态下分解制得。
【三氧化硫】又称硫酸酐, 化学式SO3。式量SO3为80.06。无色固体, 易挥发。熔点16.8℃, 沸点44.8℃。密度2.29克/厘米3 (-10℃)。液体密度1.92克/厘米3 (20℃)。蒸气状态的分子为平面三角形。固态时有三种变体, 较重要的有α型和β型。α型是冰状结构的三聚体(SO3)3 , β型是与石棉结构相似的(SO3)n 结构。极易吸水, 溶于水生成硫酸, 并放出大量热。在空气中强烈冒“烟”。溶于浓硫酸生成发烟硫酸。是酸性氧化物, 跟氧化镁反应放热发强白光。有强氧化性是强氧化剂, 高温时氧化磷, 生成五氧化二磷和二氧化硫, 氧化碘化钾, 生成碘和亚硫酸钾。用于制硫酸、氯磺酸及有机化合物的磺化。将二氧化硫和氧气在五氧化二钒催化作用下制得。
在室温下三氧化硫是一种无色的易挥发固体,熔点289.8K、沸点317K。它是一个强氧化剂,特别在高温时它能氧化磷、碘化钾和铁、锌等金属:
5S03 + 2P ![]() 5SO2 + P2O5
5SO2 + P2O5
2KI + SO3![]() K2SO3 + I2
K2SO3 + I2
三氧化硫极易吸收水分,在空气中强烈冒烟,溶于水中即生成硫酸并放出大量热。这大量热使水蒸发,所产生的水蒸气与SO3形成酸雾,影响吸收的效果,所以工业上生产硫酸不是用水去吸收S03,而是用浓硫酸吸收SO3。将SO3溶解在浓硫酸中所生成的溶液称为发烟硫酸。当它暴露于空气中时,挥发出来的SO3和空气中的水蒸气形成硫酸的细小露滴而冒烟,所以称为发烟硫酸。通常以游离SO3的含量来标明不同浓度的发烟硫酸,如20%、40%等发烟硫酸即表示在100%硫酸中含有20%或40%游离的SO3。
【连二亚硫酸钠】又称保险粉。在空气中极易被氧化,不便于使用,经酒精和浓NaOH共热后,就成为比较稳定的无水盐。
Na2S2O4是一种白色固体,加热至402K即分解:
2Na2S2O4![]() Na2S2O3 + Na2SO3 + SO2
Na2S2O3 + Na2SO3 + SO2
从硫的电势图可见,Na2S2O4是一个很强的还原剂,它的水溶液在空气中放置能被空气中的氧氧化,生成亚硫酸盐或硫酸盐,因此,Na2S2O4在气体分析中用来吸收氧气:
2Na2S2O4 + O2 + 2H2O ![]() 4NaHSO3
4NaHSO3
Na2S2O4 + O2 + H2O ![]() NaHSO3 + NaHSO4
NaHSO3 + NaHSO4
Na2S2O4是印染工业中非常重要的还原剂,有许多有机染料都能被它还原,它还用于染料合成、造纸、保存食物和医学等部门。
【焦硫酸】一种无色的晶状固体、熔点308K。当冷却发烟硫酸时, 可以析出焦硫酸晶体。
焦硫酸可看作是由两分子硫酸脱去一分子水所得的产物:
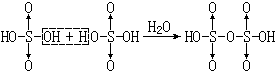 |
焦硫酸与水反应又生成H2SO4。焦硫酸具有比浓硫酸更强的氧化性,吸水性和腐蚀性,在制造某些染料、炸药中用作脱水剂。
将碱金属的酸式硫酸盐加热到熔点以上,可得焦硫酸盐。
2KHSO4 ![]() K2S2O7 + H2O
K2S2O7 + H2O
进一步加热,分解为K2SO4和SO3
K2S2O7 ![]() K2SO4 + SO3
K2SO4 + SO3
焦硫酸盐在无机合成上的一个重要用途是与一些难熔的碱性金属氧化物(如Fe2O3,Al2O3,TiO2等)共熔生成可溶性的硫酸盐。
Fe2O3 + 3K2S2O7 ![]() Fe2(SO4)3 + 3K2SO4
Fe2(SO4)3 + 3K2SO4
Al2O3 + 3K2S2O7 ![]() Al2(SO4)3 + 3K2SO4
Al2(SO4)3 + 3K2SO4
【过硫酸】可以看成是过氧化氢中氢原子被HSO3- 取代的产物。HO·OH中一个H被HSO3- 取代后得HO·OSO3H,即过一硫酸;另一个H也被HSO3- 取代后,得HSO3O0·0SO3H,即过二硫酸,它的结构式见表12-4。
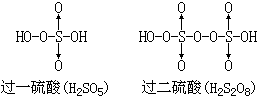 |
过二硫酸是无色晶体,在338K时熔化并分解,具有极强的氧化性,它不仅能使纸炭化,还能烧焦石蜡。
所有的过硫酸盐都是强氧化剂。例如,过硫酸钾和铜能按下式反应:
Cu + K2S2O8 ![]() CuSO4 + K2SO4
CuSO4 + K2SO4
过硫酸盐在Ag+ 离子的作用下,能将Mn2+ 氧化成MnO4- 离子:
2Mn2+ + 5S2O82- + 8H2O ![]() 2Mn04- + 10S042- + 16H+
2Mn04- + 10S042- + 16H+
在钢铁分析中常用过硫酸铵(或过硫酸钾)氧化法测定钢中锰的含量。
应该指出,过二硫酸及其盐作为氧化剂在氧化还原反应过程,它的过氧链断裂,其中两个氧原子的氧化数从-Ⅰ降到-Ⅱ,而硫的氧化数不变仍然是+Ⅵ。
过硫酸及其盐都是不稳定的,在加热时容易分解,例如,K2S2O8受热时会放出SO3和O2:
2K2S2O8 ![]() 2K2SO4 + 2SO3 + O2
2K2SO4 + 2SO3 + O2
【硫酸】化学式H2SO4 , 式量98.08。纯硫酸为无色油状液体。市售浓硫酸含H2SO4 96~98%,密度1.841克/厘米3 。凝固点10.4℃,沸点338℃(98.3%)浓硫酸有强烈吸水性,能与水以任意比混溶, 并放出大量热,这是水合作用的结果。用水稀释浓硫酸时, 只能在搅拌下将浓硫酸徐徐注入水中,切勿将水注入浓硫酸中。有强烈脱水性, 从有机物中按水的组成夺取氢、氧原子,并能使某些有机物碳化。硫酸是二元强酸, 纯硫酸中存在大量未电离分子,几乎不导电。它的水溶液导电, 第一步电离完全,第二步电离不完全K2 =1.2×10-2 。稀硫酸具有酸的通性,其中H+ 也有氧化性。浓硫酸有强氧化性,可以氧化金、铂等以外的大多数金属和许多非金属。
铁、铝、铬等在冷、浓硫酸中发生钝化。浓硫酸将H2S氧化析出硫, 将NaBr氧化生成溴, 将KI氧化生成碘。跟苯等有机物发生磺化反应。硫酸是化学工业中最重要的产品之一, 广泛用于生产化肥、农药、染料、炸药、人造纤维、精炼石油、冶金、金属加工、有机合成、铀矿加工等。工业上用接触法或铅室法制硫酸。接触法是以硫或黄铁矿(FeS2 )为原料, 在空气中燃烧生成二氧化硫, 在五氧化二钒催化剂作用下, 二氧化硫被氧化生成三氧化硫, 用98.3%的硫酸吸收三氧化硫, 再用水稀释制得。
【硫化氢】化学式H2S, 式量34.08, 有腐卵臭味的无色气体,有毒。分子结构与水相似, 呈V形,有极性。密度1.539克/升,熔点-85.5℃, 沸点-60.7℃。能溶于水,水溶液叫氢硫酸, 还能溶于乙醇和甘油。完全干燥的硫化氢常温下不与空气中氧气反应,点火时可燃烧、有蓝色火焰。空气充足时生成二氧化硫和水,若空气不足或温度较低时生成硫和水。能使银、铜制品表面变黑,生成金属硫化物。有较强的还原性, 跟二氧化硫反应生成硫和水,跟浓硫酸反应生二氧化硫和硫, 跟氯气反应生成硫和氯化氢,跟三价铁盐溶液生成二价铁盐和硫, 使硝酸还原为二氧化氮,使I2 还原为I- ,使MnO4- 还原为Mn2+ ,反应中H2S通常被氧化为S, 若氧化剂氧化性较强并过量时,H2S还可能被氧化成H2SO4。H2S能跟多种金属离子反应可成不溶于水和酸的硫化物沉淀。用于分离和鉴定金属离子,精制盐酸, 制备单质硫。由硫化亚铁跟盐酸或用硫蒸气跟氢气化合制备。
【氢硫酸】化学式H2S, 式量34.08, 硫化氢的水溶液叫氢硫酸,有腐卵臭味。是很弱的酸, 在18℃时的电离常数为:K1=9.1×10-8 , K2=1.1×10-12 。在空气中易被氧化析出硫,溶液变浑浊。
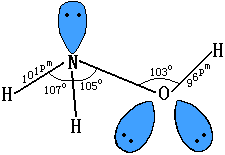
【水】分子式为H2O, 水在地球表面上分布最广, 约占地球表面的3/4, 大气中含有水蒸气, 土壤、岩石、动植物体中也含有大量的水, 动物体中的水约占70%, 新鲜植物体中的水分约占80~90%, 地球上水的含量约有2×1018 吨。
18世纪以前, 人们认为水是一种单质, 1781年英国化学家卡文迪许首先发现氢气在空气中燃烧生成的唯一产物是水, 证明水是由氢、氧两种元素组成的化合物。几年以后, 拉瓦锡测定了水的质量组成。近代结构理论证明, 水分子呈V(形结构)。用x射线测定水的晶体(冰)结构, 证明两个O—H键间形成104.5°的键角, 由于水分子是不对称结构, 故知水是极性分子。实验还证明, 水分子通过氢键发生缔合, 形成较复杂的分子集团, 水沸腾时水蒸气中含有3.5%的双分子水(H2O)2, 液态水中含有较复杂的(H2O)n分子(n可以是2、3、4…), 这些较复杂的缔合水分子的化学性质和水(H2O)相同。
纯水是无色、无嗅、无味的液体, 深层的天然水呈蓝绿色。水的热容为4.1868焦尔/克·度(1卡/克·度), 在所有液态和固态物质中, 水的热容最大。水在4℃时密度为1克/厘米3 。在101325帕(1大气压)时, 水的沸点为100℃, 水的气化热为2.257千焦/克, 凝固点是0℃。水是极弱的电解质, 可发生自偶离解:
H2O+H2O H3O+ +OH-
H3O+ +OH-
常温下, 水的电离常数为1.8×10-16 , 水的离子积Kw=1×10-14 。
水是较稳定的化合物, 在1000℃以上才开始分解。在硫酸或氢氧化钠等存在条件下, 电解水可生成氢气和氧气。许多活动性强的金属如K、Na、Ba、Ca等在常温下可跟水反应生成碱和氢气, Mg、Al在加热至水沸腾时跟水反应生成碱和氢气。水可跟许多较活动金属如锌、铁等在高温下反应生成金属氧化物和氢气。水可跟某些非金属反应, 如:
2F2+2H2O=4HF+O2↑
Cl2+H2O HCl+HClO
HCl+HClO
C+H2O CO+H2
CO+H2
水可以跟许多碱性氧化物如K2O、Na2O、CaO、BaO、MgO等化合生成碱, 水可以和多种酸性氧化物SO3、SO2、CO2、P2O5等化合生成相应的酸。水还能跟某些盐或酯、糖等有机物发生水解反应。
水是一种广泛应用的溶剂, 极性物质(如HCl、NaCl等)容易在水中溶解。
【高分子溶液】高分子化合物溶于适当的溶剂中可形成高分子溶液。高分子溶液具有双重性质, 一方面由于这种分散相微粒大小与溶胶粒子相近, 表现出溶胶的某些特性;另一方面高分子溶液是分子分散体系, 又有某些真溶液的特点。
高分子溶液和胶体溶液有许多不同之处:
(1)高分子溶液是单相体系, 胶体是多相体系。
(2)高分子溶液分散相极易溶剂化, 这是因为高分子化合物组成中, 常含有大量亲水基团, 如—OH、-COOH、-NH2等, 而胶体微粒的溶剂化能力比高分子化合物弱得多。
(3)高分子溶液中分散相微粒一般不带电荷, 胶体微粒则是带电的, 高分子溶液的稳定性是它的高度溶剂化起了决定性作用。
(4)高分子化合物溶解的过程就是溶剂化过程, 当用蒸发的方法除去溶剂后再加入溶剂仍能自动溶解, 它的溶解过程是可逆的, 而胶体中的胶粒一旦凝聚, 一般很难或者不能用简单加入溶剂的方法使之复原。高分子溶液还有一项与真溶液和溶胶都不同的特性, 就是有较大的粘度。
【白磷】 化学式为P4,白色腊状具大蒜气味的固体,放久变黄。极毒(成人误服50毫克/千克可致死)。密度1.82(20℃)克/厘米3 ,熔点44.1℃,沸点 280℃,难溶于水,溶于苯、乙醇,易溶于CS2。在空气中可发绿色磷光。易自然,着火点仅34℃,必须贮存在水中(切割时也应在水下进行)。化学活拨性比红磷大。以还原性为主,与卤素、硫、氧反应时皆为还原剂。在强碱中能发生歧化反应:
P4+3NaOH+3H2O =PH3↑+3NaH2PO2(次磷酸钠)
用此法可制PH3但副产物为自然的联瞵P2H4,而制得的PH3也能自燃。白磷在常温下可以与CuSO4溶液发生反应:
2P+5CuSO4+8H2O =5Cu+2H3PO4+5H2SO4
如不小心把白磷沾到皮肤上,用CuSO4溶液冲洗即利用这一反应。加热时反应变为:
11P+15CuSO4+24H2O =5Cu3P+6H3PO4+15H2SO4
白磷主要用于生产磷酸、三氯化磷、三氯氧磷(POCl3)和五硫化二磷等,供农药生产使用。少量白磷用于生产红磷和磷酐,军事上用于烟幕弹,曳光弹、信号弹、燃烧弹。一般用磷矿粉、砂、焦炭于电炉中制取:
2Ca3(PO4)2+10C+6SiO2 P4+6CaSiO3+10CO↑
P4+6CaSiO3+10CO↑
白磷为制红磷与黑磷的原料,隔绝空气加热则缓缓转化为红磷,在较高温(220℃)和高压条件下则渐渐转变为黑磷。
白磷为正四面体分子,由四个磷原子构成,键角为60°,与五原子构成的正四面体分子键角109°28'不同。