
|
学习小专题 |
一般指中心原子获得电子显示氧化性的酸。如浓硫酸、硝酸、氯酸、高氯酸、高锰酸、重铬酸等,其中心原子在氧化-还原反应中容易获得电子而显示氧化性,可用作氧化剂。任何酸的水溶液中都不同程度地电离出H+,H+在一定条件下可获得电子而形成H2,这也是酸的氧化性的表现,实质上是H+的一种性质。应该与酸的中心原子获得电子所呈现的氧化性区别开来。通常把盐酸、稀硫酸等称作为非氧化性酸。
【同素异形体】(亦称同素异性体)同种元素组成的不同单质,例如石墨和金刚石、氧气和臭氧、白磷和红磷等。同素异形体的分子组成或晶体结构不同,它们的物理性质和化学性质有明显的区别,
例如金刚石是由碳原子以共价键连接形成的正四面体空间网状结构的原子晶体;石墨是一种层状结构的过渡型晶体,层内碳 原子以共价键结合形成正六边形网状结构,层与层之间距离较大,相当于分子间力的作用。金刚石是硬度最大的物质,不能导电;而石墨的硬度较小,层之间可以相 对滑动,导电性好,化学性质较金刚石活泼。
又如白磷和红磷,白磷是由正四面体结构的分子(P4)组成,为白色腊状固体,有剧毒,易溶于CS2,着火点低(40℃),在空气中可自燃;红磷是较复杂的层状晶体,红色粉末,无毒,不溶于CS2,着火点240℃。隔绝空气加热温度升至260℃时,白磷转变成红磷,红磷受热在416℃时先升华,蒸气冷却又变为白磷。
O2和O3的分子组成不同,O3是较O2更活泼的氧化剂。
【硫代硫酸钠】俗名海波或大苏打。化学式Na2S2O3·5H2O,式量248.18。无色透明,单斜晶体,密度1.729克/厘米3,在33℃以上的干燥空气里风化。易溶于水,水溶液呈弱碱性,不溶于乙醇。56℃时溶于结晶水中,100℃时失水,灼烧时分解为硫化钠及硫酸钠,跟强酸反应析出硫并放出二氧化硫。Na2S2O3+H2SO4 =Na2SO4 +S↓+SO2↑+H2O ;其水溶液可溶解溴化银或氯化银。AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr 。因此,可用做照像的定影剂。海波有还原性,可用做去氯剂、媒染剂,还常用做分析试剂,如氧化-还原滴定剂。用亚硫酸钠溶液跟硫共煮后过滤、蒸发、结晶即得硫代硫酸钠晶体。
硫代硫酸钠在中性、碱性溶液中很稳定,在酸性溶液中迅速分解。
Na2S2O3 + 2HCl ![]() 2NaCl + S↓ + SO2↑ + H2O
2NaCl + S↓ + SO2↑ + H2O
硫代硫酸钠是一种中等强度的还原剂,与碘反应时,它被氧化为连四硫酸钠;与氯、溴等反应时被氧化为硫酸盐。因此,硫代硫酸钠可做为脱氯剂。
2Na2S2O3 + I2![]() Na2S4O6 + 2NaI
Na2S4O6 + 2NaI
Na2S2O3 + 4Cl2 + 5H2O ![]() 2H2SO4 + 2NaCl + 6HCl
2H2SO4 + 2NaCl + 6HCl
硫代硫酸根有很强的配位能力
2S2O32- + Ag+ ![]() [Ag(S2O3)2]3-
[Ag(S2O3)2]3-
照相底片上未曝光的溴化银在定影液中即由于形成这个配离子而溶解。
 |
| 重过磷酸钙 |
【熟石膏】主要成分CaSO4·H2O,白色粉状固体。由生石膏CaSO4·2H2O,在150℃时脱水生成。熟石膏跟水混和成糊状逐渐硬化并膨胀,可用来制石膏塑像、模型、粉笔及医用石膏绷带等。
【石膏】又称生石膏,主要成分是CaSO4·2H2O。常见的硫酸盐矿物。系无色、白色、灰色、淡黄色、粉红色、透明或半透明的单斜晶体。有玻璃光泽,常为块状,纤维状或片状,完全解理,质脆、密度2.32克/厘米3、硬度2.0,微溶于水。细粒致密块状的称为雪花石膏。128℃失3/2H2O,150℃脱水成熟石膏(CaSO4·H2O),加热到500℃以上成无水石膏。用于制造硫酸,水泥,熟石膏,还用作制油漆,纸张的填料,制豆腐的凝结剂。中医用它做清热药,性大寒,味辛甘,可治高烧、烦渴、肺热喘嗽和胃火牙痛等。
【发烟硫酸】化学式H2SO4 ·xSO3。将三氧化硫溶解在浓硫酸中所形成的溶液称为发烟硫酸。无色油状液体。其密度、熔点、沸点随着三氧化硫的含量不同而改变。通常以游离SO3的含量未标明不同浓度的发烟硫酸,如40%发烟硫酸即表示在发烟硫酸中含有40%游离的SO3。一般使用的有20%发烟硫酸,密度为1.9克/厘米3,熔点-11℃,沸点166.6℃。发烟硫酸暴露在空气中,挥发出来的SO3,和空气中的水蒸气形成硫酸细小液滴而“发烟”。有吸水性、腐蚀性、脱水性,强氧化性。用作硝酸脱水剂、有机合成的磺化剂、有机硝化反应中的脱水剂。还用于精炼石油。
 |
| 发烟硫酸 |
单质磷有几种同素异形体,其中白磷或黄磷是白色或淡黄色腊状晶体,是由P4分子组成的分子晶体,P4分子是四面体构型。密度1.82克/厘米3,熔点44.1℃,沸点280℃,着火点40℃,有蒜臭气味,有剧毒,致死量为60~100毫克。难溶于水,易溶于二硫化碳,在气态和溶液中以P4形式存在。
白磷在潮湿空气中缓慢氧化,部分反应的能量以光能的形式释放出来,故在暗处可看到磷光。白磷在空气中经缓慢氧化,积蓄热量使温度达到着火点,引起自燃。白磷隔绝空气加热到400℃数小时可转化为红磷。
红磷是暗红色粉末,是磷的一种稳定变体,无定形体。密度2.2克/厘米3,不溶于水和二硫化碳等一般溶剂,熔点590°(4355.9千帕——43大气压),沸点200℃,着火点240℃。无毒。在416℃时红磷升华,它的蒸气冷却后变成白磷。在1.2×109千帕(12000大气压)和200℃时,白磷可转变成一种黑色同素异形体——黑磷,它有石墨状片层结构,呈铁灰色,有金属光泽,能导电,密度2.25~2.69克/厘米3,燃点490℃。白磷化性活动,红磷次之,黑磷化学活动性最差。磷的各种单质都能燃烧生成五氧化二磷;白磷、红磷都易与卤素化合,生成三卤化磷或五卤化磷。
白磷溶于热浓碱液中生成磷化氢和次磷酸盐,如:P4+3KOH+3H2O=PH3↑+3KH2PO2 ,
白磷可跟金、银、铜、铅盐溶液反应。
如:2P+5CuSO4+8H2O=5Cu+2H3PO4+5H2SO4 ;11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4
白磷用于制磷酸、烟雾弹、杀鼠药等。红磷用于制火柴和农药等。1669年德国的布兰特从人尿蒸馏和干馏后的物质中制得白磷。自然界中磷以磷酸盐的形式存在,主要矿石有磷灰石。磷也构成生物体的重要元素,存在于细胞、骨骼、蛋白质中。工业上将磷酸钙、二氧化硅和焦炭混和在电炉中反应制得白磷。
银白色或微红色有金属光泽的晶体,熔点271.4℃,沸点1560±5℃,蒸气分子中单原子分子和双原子分子处于平衡状态。主要氧化数-3、+1、+3、+5。质脆而硬,凝固时体积膨胀,膨胀率为3.3%。密度9.747克/厘米3。
常温下在干燥空气中稳定,在潮湿空气中可被氧化。红热时燃烧呈蓝色火焰,生成黄色氧化物Bi2O3。常温下不跟水反应,红热时能被水蒸气缓慢氧化。铋粉可在氯气中自燃,加热时跟溴、碘、硫、硒直接化合生成三价化合物。不溶于稀盐酸和稀硫酸,溶于硝酸和浓硫酸生成三价铋盐。
1753年英吉甫鲁瓦发现了铋。自然界中有游离态和化合态两种形式。主要矿物有辉铋矿、铋华等。在地壳中的丰度为2.0×10-5%。主要用于制低熔点合金(熔点在45℃以上100℃以下),在消防和电气工业上用作自动灭火装置和保险丝及焊锡。还用于制活字合金、医药等。由煅烧辉铋矿得三氧化二铋,再与碳共热还原得到铋。
锑有几种同素异形体。通常最稳定的是灰锑,银白或银灰色菱形晶体,脆而硬,由液态凝固时体积膨胀,即有冷胀性,密度6.68克/厘米3,熔点 630.74℃,沸点1750℃,锑蒸气分子为Sb4,导电性差。此外还有灰色的无定形锑,黄色的黄锑,黑色的黑锑等。
锑化学性质不很活动。室温下不能被空气中氧气氧化,但能跟氟、氯、溴化合生成三价或五价卤化物。加热时可跟碘、硫化合。高温时燃烧显蓝色并生成Sb4O6。常温时不跟水反应,红热时跟水反应放出氢气。跟热硝酸反应,生成水合氧化锑:6Sb+10HNO3+3xH2O=3Sb2O5·xH2O+10NO↑+5H2O ,能溶于热的浓盐酸和硫酸生成氯化锑和硫酸锑。与强碱反应生成亚锑酸盐,主要用于制合金如印刷用的活字合金、硬质合金、巴氏合金。还用于制锑盐、医药、颜料及半导体材料等。古代已应用锑及其化合物。在自然界中有游离态和化合态两种形式存在,主要矿物有辉锑矿(Sb2S3)和方锑矿(Sb2O3)。
在地壳中的丰度为1.0×10-4%。用辉锑矿跟铁屑共热,或用三氧化二锑与碳共热都可还原出锑。
【雌黄】矿物名。化学成分为As2S3。单斜晶系,晶体常呈柱状。集合体呈短柱状,板状。柠檬黄色,有时微带浅褐色。有金刚光泽或珍珠光泽。质脆,解理完全。灼烧后发出强烈的蒜臭。用于提取三氧化二砷,制造玻璃、颜料等。
【雄黄】矿物名。化学成分为AsS,也称鸡冠石。单斜晶系,晶体为柱状,大多成块状集合体。多数为桔红色。半透明,晶面有金刚光泽。密度3.5克/厘米3。难溶于水。质脆,有毒。用于提炼砷,制取三氧化二砷。还用于制颜料、玻璃、焰火。中医药用为解毒、杀虫药,外用治癣疥恶疮、蛇虫咬伤;内服微量治惊痫、疮毒等。
【砒霜】别名亚砷酸酐,俗称砒霜,化学式As2O3,式量197.84。白色粉末,微溶于水。两性氧化物,溶于盐酸生成三氯化砷,溶于氢氧化钠和碳酸钠溶液生成亚砷酸钠。约193℃升华,剧毒,致死量约0.06克。用于制亚砷酸盐、医药、防腐剂。由砷燃烧制得。
俗名砒。有三种同素异形体:黄色的α体、黑色的β体和灰色的γ体。室温下最稳定的是γ体,有明显的金属性质,硬而脆,密度 5.73克/厘米3,熔点817℃(2836.4千帕——28大气压),613℃升华。气态分子组成为As4(800℃)。
游离态砷化性很活泼,在空气中加热至200℃时有荧光出现,在400℃时燃烧呈蓝色火焰,并形成白色的氧化砷烟(As4O6),易与氟、氮化合,在加热时也易和大多数金属和非金属化合。不溶于水。能被硝酸或浓硫酸氧化生成砷酸,如:3As+5HNO3+2H2O=3H3AsO4+5NO
跟熔融氢氧化钠反应生成亚砷酸钠Na3AsO3并放出氢气。能溶于王水。砷及其化合物都有毒。砷在自然界分布很广,主要以化合态存在,少量以游离态存在。在地壳里丰度为5.0×10-4%,重要矿物有毒砂FeAsS、雄黄As2S2、雌黄As2S3和白砷石As2O3等。1250年罗马的马格努斯用雄黄共热发现了砷。主要用途是与铅、铜、锌等制成合金,也用于制医药和杀虫剂以及半导体材料如砷化镓。由三氧化二砷跟碳反应制得。
【概述】化学式HN3,式量43.03。无色有刺激性气味的液体,沸点35.8℃,熔点-80℃。是易爆物质,受到撞击立即爆炸、分解。2HN3=3N2+H2,稀溶液几乎不分解。HN3为弱酸Ka=1.9×10-5 。用稀硫酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得: NaNH2+N2O=NaN3+H2O
【性质】
它是易爆物质,只要受到撞击就立即爆炸而分解。
2HN3![]() 3N2+H2 ;ΔrHθ =-593.6KJ·mol-1
3N2+H2 ;ΔrHθ =-593.6KJ·mol-1
因为HN3的挥发性高,可用稀H2SO4与NaN3作用制备HN3:
NaN3+H2SO4![]() NaHSO4+HN3
NaHSO4+HN3
NaN3可从下面反应得到:
3NaNH2+NaNO3![]() NaN3+3NaOH + NH3
NaN3+3NaOH + NH3
HN3的水溶液为一元弱酸(K=1.9×10-5 ),它与碱或活泼金属作用生成叠氮化物。
HN3+NaOH![]() NaN3+H2O
NaN3+H2O
2HN3+Zn![]() Zn(N3)2+H2
Zn(N3)2+H2
HN3中N的氧化态为-1/3,所以它既显氧化性又显还原性。HN3的水溶液会发生歧化分解。
HN3+H2O![]() NH2OH + N2
NH2OH + N2
活泼金属如碱金属和钡等的叠氮化物,加热时不爆炸,分解为氮和金属。
2NaN3(s)![]() 2Na(l) + 3N2(g)
2Na(l) + 3N2(g)
加热LiN3则转变为氮化物。象Ag、Cu、Pb、Hg等的叠氮化物加热就发生爆炸,基于这一性质,Pb(N3)2和Hg(N3)2可做为雷管的起爆剂。
【概述】
别名肼,化学式NH2—NH2。无色油状液体,与水、乙醇互溶。熔点2℃,沸点113.5℃,有氨的气味,剧毒。联氨可看做是氨分子内的一个氢原子被氨基取代的衍生物。有碱性,可与无机酸反应生成盐。在水溶液中既显氧化性又显还原性。在酸性溶液中是强氧化剂。在强碱性溶液中是强还原剂。有强腐蚀性,可腐蚀玻璃、橡胶、软木等。有可燃性:N2H4(液)+O2(气)=N2(气)+2H2O(液);ΔH=-624千焦/摩尔 ,用作火箭燃料,医药原料,也常用作还原剂、显影剂。
【结构】
联氨
【性质】
1、纯联氨是一种可燃性的液体,它在空气中发烟,能与水及酒精无限混合。在加热时联氨便发生爆炸性的分解。它在空气中燃烧放出大量的热。它的烷基衍生物可作为火箭的燃料。
N2H4(l)+O2(g) N2(g)+2H2O(1) ΔrHθ =-624KJ·mol-1
N2(g)+2H2O(1) ΔrHθ =-624KJ·mol-1
2、联氨可以接受两个质子而显碱性,是二元弱碱,碱性稍弱于氨。
N2H4+H2O N2H5+ +OH- K1=1.0×10-6 (298K)
N2H5+ +OH- K1=1.0×10-6 (298K)
N2H5+ +H2O N2H62+ +OH- K2=9.0×10-16 (298K)
N2H62+ +OH- K2=9.0×10-16 (298K)
它生成的两类盐中,一价酸根的盐如N2H5Cl较稳定,而N2H62+ 离子所生成的盐均易水解.
3、联氨是一种强还原剂,在碱性溶液中能将CuO、IO3- 、Cl2、Br2等还原,本身被氧化为N2。
4CuO+N2H4=2Cu2O+N2+2H2O
2IO3- +3N2H4=2I- +3N2+6H2O
随着参加反应的氧化剂不同,N2H4的氧化产物除了N2,还有NH4+ 和HN3。
2MnO4- +10N2H5+ +6H+ =10NH4+ +5N2+2Mn2+ +8H2O
N2H5+ +HNO2=HN3+H+ +2H2O
【制取】
先用氯跟稀氨水反应制得氯氨NH2Cl,然后加过量氨即得联氨。
2NH3+Cl=NH2Cl
2NH3+NH2Cl=N2H4+NH4Cl
【亚硝酸】化学式HNO2,式量47.02。是三价氮的含氧酸,酸酐为三氧化二氮。亚硝酸仅存在于稀溶液中,溶液显微蓝色。很不稳定,受热即分解为NO2、NO和H2O。是弱酸(略强于醋酸)。既有氧化性又有还原性。用于有机合成中伯胺的重氮化反应。可将等摩尔的NO2和NO混和物通入冷水中制得。工业上用亚硝酸钠跟盐酸反应制得。
当将等物质的量的NO和NO2混合物溶解在冰水中或向亚硝酸盐的冷溶液中加酸时,生成亚硝酸:
NO + NO2 + H2O ![]() 2HNO2
2HNO2
NaN02 + H2SO4![]() HNO2 + NaHSO4
HNO2 + NaHSO4
亚硝酸很不稳定,仅存在于冷的稀溶液中,微热甚至冷时便分解为NO、NO2和H2O。
亚硝酸是一种弱酸,但比醋酸略强。
HNO2 ![]() H+ + NO2- Ka=5×10-4 (291K)
H+ + NO2- Ka=5×10-4 (291K)
在亚硝酸中,N的氧化数为+Ⅲ,处于中间状态,因此,它既可作氧化剂又可作还原剂,其氧化性比稀硝酸还强。无论在酸性还是碱性介质中,其氧化性都大于还原性,即亚硝酸的氧化性是主要的。
【氮气】无色无味气体,标准状况下密度1.2506克/升,液氮0.8081克/厘米3。沸点-195.8℃,熔点-209.86℃,难液化在水里溶解度很小,20℃时1体积水仅溶解0.0155体积N2。空气溶入水的O2比N2多,升温使溶于水的空气逸出其含氧量高于普通空气。
氮元素是相当强的非金属,次于氟、氧、氯居第四位。N2分子中N≡N键能很大,达949千焦/摩,不易解离为原子,而表现出稳定性和化学惰性。高温或放电条件下分子中化学键破坏而能与多种元素反应。如与H2生成NH3;与Mg、Ca、Sr、Ba生成氮化物Mg3N2、Ca3N2等;与O2在电弧高温下少量反应生成NO,此反应吸热是O2与其它物质化合时所罕见的。对碱金属只易与锂化合成氮化锂Li3N,却不与其它碱金属直接反应。
主要用于合成氨以制化肥、硝酸、炸药、塑料等。N2不支持呼吸而用于保存粮食、水果,以减缓代谢,使害虫缺氧死亡。N2稳定而用做某些金属焊接时的保护气;于白炽灯内充入一定量Ar、N2混合气能防止钨丝氧化和减慢挥发。液氮可达-196℃低温,用做深度致冷剂,医疗上用液氮冻掉疣瘤,科研上也常用液氮致冷。
【氨气】无色气体,具特有的强烈刺激性气味。密度0.771克/升(标准状况),比空气轻。沸点-33.35℃,高于同族氢化物PH3、AsH3,易液化。熔点-77.7℃。液氨密度0.7253克/厘米3,气化热大,达23.35千焦/摩,是常用的致冷剂。极易溶于水,20℃时1体积水能溶解702体积NH3。充满NH3的烧瓶做喷泉实验后得到的稀氨水约为0.045摩/升。用水吸收NH3时要用“倒放漏斗”装置以防倒吸。液氨是极性分子,似水,可发生电离:

也能溶解一些无机盐如NH4NO3、AgI。空气中允许NH3最高含量规定为0.02毫克/升,若达0.5%则强烈刺激粘膜,引起眼睛和呼吸器官的症状。
氨气较为稳定,具碱性和弱还原性。常见反应如体现其碱性的加合,与水生成NH3·H2O,在溶液中有平衡关系:

属于NH3的孤对电子与H+空轨道形成配位键的加合。此外NH3的孤对电子与某些物质形成配位键而使氨水能溶解AgCl、AgBr、AgOH、Ag2O生成

HCl相遇出白烟(微粒NH4Cl),可彼此互验。氨的弱还原性表现于如对O2、

有:
4NH3+3O2(纯) 2N2+6H2O
2N2+6H2O

8NH3+3Cl2 N2+6NH4Cl
N2+6NH4Cl
氨气大量用于生产化肥:尿素CO(NH2)2、硫铵(NH4)2SO4,硝铵NH4NO3等。生产纯碱用NH3与NaCl、H2O和CO2反应,副产品是氯铵NH4Cl化肥。氨还用于生产合成材料如聚氨酯塑料、丁腈橡胶,粘合剂,染料和一些药品和医药。氨氧化法可生产硝酸用于制造炸药和染料。10%的氨水可用于减轻皮肤上蚊虫叮咬的伤痛,其刺激气味可用于使处于麻醉状态和昏厥状态的人苏醒。
N2+3H2 2NH3;ΔH<0
2NH3;ΔH<0
最适条件是以铁触媒为催化剂在高温、高压下反应,温度400~550℃,过高则化学平衡强烈向左移动,过低则反应速度过慢,降低单位时间氨产量,此温度也是催化剂活性最强的温度范围。压强高平衡右移有利于NH3的生成,但过高则给设备和技术条件造成困难,常以150~300兆帕为宜,过低则平衡右移微弱致使NH3产量降低。工业上以空气、水、煤、天然气、石化产品等首先制得N2、H2,经严格提纯(防止催化剂中毒),给N2:H2=1:3(体积)的混合气体施以高压,通入装有铁触媒的合成塔,在高压和400~550℃条件下反应,仅有部分N2、H2合成NH3。再导出冷却分离出NH3后将未反应的N2、H2循环使用,以提高原料利用率降低成本。若以焦炭、水、空气为原料时,理论上用于计算的关系式为3C~4NH3。
【硝酸】无色液体,密度1.5027克/厘米3,熔点—42℃,沸点83℃,不断挥发出的蒸气有毒性和腐蚀性气味,易溶于水,属于挥发酸。常用者为68%溶液,无色,密度1.41克/厘米3,约相当于15摩/升。沸点120.5℃。93%HNO3因溶入NO2而呈黄至棕黄色,开盖则逸出棕色浓雾,叫发烟硝酸。应密闭保存于棕色玻璃塞瓶中,不可用无色试剂瓶和橡皮塞,以防见光分解,挥发和腐蚀橡皮。
HNO3具强酸性,强氧化性,浓硝酸能与除Au、Pt、Ta、Rh、Ir等很不活动金属外的所有金属反应。与冷浓HNO3呈钝态的金属有Fe、Al、Cr;生成可溶性硝酸盐与NO2。(有时杂有NO)的有Cu、Ag、Hg等;生成含氧酸或氧化物的有Sn、Sb、W、Mo等。对非金属可把C、S、P氧化为CO、H2SO4、H3PO4。稀硝酸氧化性比浓硝酸弱。因浓度不同还原产物可出现NO、N2O、铵盐等。个别杂有H2。实际上还原产物是不单一的,只是以某种为主,如6~8摩/升HNO3还原产物以NO为主。
硝酸不能与HI、H2S、HBr、Fe2+、SO2、亚硫酸盐等有明显还原性物质共存,因条件不同可将它们氧化为I2或HIO3、S或H2SO4、Br2、Fe 3+ 、H2SO4、硫酸盐等。
在光、热条件下分解,也能与木屑、碎布等可燃性有机物反应甚至燃烧,或自燃。保存时应使用棕色玻璃寒瓶,远离火源和叮燃有机物。浓硝酸与浓盐酸以体积比1:3混合而成“王水”能溶解Au、Pt等,王水不稳定,要现用现配。
历史上曾用智利硝石与浓硫酸共热制取。现改用氨氧化法制取,其法以氨和空气为原料,用Pt—Rh合金网为催化剂在氧化炉中于800℃进行氧化反应,生成的NO在冷却时与O2生NO2,NO2在吸收塔内用水吸收在过量空气中O2的作用下转化为硝酸,最高浓度可达50%。制浓硝酸则把50%HNO3与Mg(NO3)2或浓H2SO4蒸馏而得。主要生产阶段的反应为:

4NO+2O2 4NO2
4NO2
4NO2+O2+2H2O 4HNO3(即有O2时,计算时关系式为NH3~HNO3。)
4HNO3(即有O2时,计算时关系式为NH3~HNO3。)
硝酸厂尾气中氮的氧化物>0.4%(体积)需用碱液吸收制成NaNO2:NO+NO2+NaOH NaNO2+H2O,否则,严重污染大气。
NaNO2+H2O,否则,严重污染大气。
 N2O4;ΔH<0,冷却或加压则平衡右移。常温时NO2中有一定量N2O4,而使实测的分子量比由NO2分子式算出的数值稍大。具氧化性,能与热铜反应生成N2与CuO,也能使KI—淀粉湿试纸变蓝,对橡胶腐蚀严重。
N2O4;ΔH<0,冷却或加压则平衡右移。常温时NO2中有一定量N2O4,而使实测的分子量比由NO2分子式算出的数值稍大。具氧化性,能与热铜反应生成N2与CuO,也能使KI—淀粉湿试纸变蓝,对橡胶腐蚀严重。【概述】
皆为易溶于水的晶体,结晶水合物的颜色由阳离子而定,一般皆易溶于水。
常温下除AgNO3等少数见光易分解外,其它都较稳定。其热分解产物与阳离子有关,可大致参照金属活动性分为:
Mg以前金属硝酸盐热分解成亚硝酸盐与O2;
Mg~Cu间金属硝酸盐热分解产物为氧化物、O2与NO2;
位于Cu以后的产物则为单质、NO2、O2。
特殊情况如LiNO3分解为Li2O等而不是LiNO2,Mn(NO3)2分解为MnO2、NO2不产生O2。
加热时硝酸盐中+5价的N氧化性显著,如黑火药中的KNO3为氧化剂,在点燃时与C、S反应而爆发。
在溶液里硝酸盐的氧化性随加酸而增强,如FeSO4与KNO3混合并不氧化Fe2+ ,但加硫酸,则很快反应生成Fe3+ 使溶液变黄。初步检验硝酸盐的方法是,将待测液蒸发浓缩,加铜与浓硫酸共热若有棕红色NO2气体产生,则原溶液中有硝酸根离子。
【性质】
硝酸盐大多是无色易溶于水的晶体,它的水溶液没有氧化性。硝酸盐在常温下是较稳定的,但在高温时固体硝酸盐会分解放出02而显氧化性。硝酸盐热分解的产物决定于盐的阳离子。碱金属和碱土金属的硝酸盐热分解放出O2并生成相应的亚硝酸盐。电位顺序在Mg和Cu之间的金属所形成的硝酸盐热分解时生成相应的氧化物。电位顺序在铜以后的金属硝酸盐则分解为金属,例如;
2NaNO3![]() 2NaNO2+O2
2NaNO2+O2
2Pb(NO3)2![]() 2PbO + 4NO2+O2
2PbO + 4NO2+O2
2AgNO3![]() 2Ag + 2NO2+O2
2Ag + 2NO2+O2
由于各种金属的亚硝酸盐和氧化物稳定性不同,所以加热分解的最后产物也不同。
【概述】NaNO2,苍黄色或无色至白色晶体,熔点271℃,在320℃分解。极易溶于水,难溶于乙醇、乙醚。在空气中逐渐吸收O2而转化为NaNO3。所以要密闭保存。有毒性,施工防冻用“工业盐”主要成分是NaNO2,要严格与食盐区别以防中毒。NaNO2中的氮呈+3价,属于中间价态,其溶液遇酸化的碘化钾淀粉则变蓝,说明亚硝酸根离子有氧化性;酸性高锰酸钾溶液遇到NaNO2则紫色褪去,说明NaNO2有还原性。NaNO2主要用于防锈剂,化工原料和腌肉制品的添加剂。工业上可用铅与NaNO3共热制取,也来自硝酸厂尾气处理(NO2+NO+2NaOH==NaNO2+H2O)的副产品。宜防潮密封保存。有强氧化性。跟硫、磷、有机物等摩擦或撞击可引起燃烧或爆炸。用做微量分析试剂、氧化剂、重氮化试剂、亚硝酸盐或亚硝基化合物的合成。大量用做防锈剂、印染、制取偶氮染料等。亚硝酸钠水溶液呈弱碱性,能从空气中吸取氧,使亚硝酸钠逐渐氧化成硝酸钠。
 |
| 亚硝酸钠 |
【亚硝酸盐】
除了浅黄色的微溶盐AgNO2外,一般亚硝酸盐易溶于水,水溶液是稳定的。亚硝酸盐,特别是碱金属和碱土金属的亚硝酸盐,都有很高的热稳定性。用粉末状金属铅、碳或铁在高温下还原固态硝酸盐,可得到亚硝酸盐,
Pb + KNO3![]() KNO2+PbO
KNO2+PbO
因亚硝酸盐中,氮原子的氧化态处于中间,因此既有氧化性又有还原性。亚硝酸盐在酸性溶液中是强氧化剂,氧化性是主要的;在碱性溶液中还原性是主要的,空气中的氧就能使NO2- 氧化为NO3- 。
例如,NO2- 在酸性溶液中能将I- 氧化为单质碘,
2NO2- + 2I- + 4H+ ![]() 2NO + I2+2H2O
2NO + I2+2H2O
这个反应可以定量地进行,能用于测定亚硝酸盐含量。用不同的还原剂,NO2- 可被还原成NO、N2O、·nH2OH、N2或NH3。当遇到更强氧化剂如KMnO4、Cl2等,亚硝酸盐则是还原剂,被氧化为硝酸盐,
2MnO4- + 5NO2- + 6H+ ![]() 2Mn2+ + 5NO3- + 3H2O
2Mn2+ + 5NO3- + 3H2O
Cl2+NO2- + H2O![]() 2H+ + 2Cl- + NO3-
2H+ + 2Cl- + NO3-
NO2- 离子是一种很好的配体,在氧原子和氮原子上都有孤电子对,它们能分别与金属离子形成配位键(如M←NO2和M←ONO),如NO2- 与钴盐能生成钴亚硝酸根配离子[CO(NO2)6]3- ,它与K+ 离子生成黄色K3[CO(NO2)6]沉淀,此方法可用于检出K+ 离子。

与碱性物质的NaOH、NH3等反应时,因碱量不同而生成正盐,一氢盐,二氢盐。
设na为H3PO4物质的量,nb为NaOH物质的量
则nb/na≤1,生成NaH2PO4,
1<nb/na<2,生成NaH2PO4与Na2HPO4混合物,
nb/na=2,生成Na2HPO4,
2<nb/na<3,生成NaH2PO4、Na3PO4混合物,
nb/na=3,生成Na3PO4。
上述反应另外产物为水。
磷酸主要用于钢管磷化、铝的阳极氧化、制取磷酸盐、生产青霉素时的酸碱度调节、食用酸性调味剂等。高纯磷酸用白磷燃烧产物P2O5与水反应制取,粗制品可用磷矿粉与硫酸反应制得。
 |
| 磷酸 |
【硫酸锌】化学式ZnSO4,是常见的一种硫酸盐。无色或白色晶体,受热时未到熔化即于600℃分解为ZnO与SO3,溶于水,常见的皓矾为七水合物ZnSO4·7H2O,无色晶体,易溶于水,280℃失水成无水物。
水溶液呈弱酸性(Zn2+水解)。与Na2S溶液产生向色沉淀ZnS;与少量NaOH溶液生成白色胶状Zn(OH)2沉淀,NaOH过量则溶为Na2ZnO2,是Zn(OH)2两性的体现之一。
若用新配制的BaS溶液与ZnSO4溶液以同摩尔浓度和等体积反应,则生成两种白色沉淀:ZnSO4+BaS=BaSO4↓+ZnS↓,摩尔比为1∶1,其遮盖力强即白色颜料锌钡白(立德粉),皓矾还用做媒染剂、收敛剂、补锌药剂、木材防腐剂等。【硫酸钙】化学式为CaSO4,无色晶体,熔点1450℃(单斜晶体), 微溶于水。
生石膏CaSO4· 2H2O是天然矿物,为白、浅黄、浅粉红至灰色的透明或半透明的板状或纤维状晶体。性脆,128℃失1.5H2O,163℃失2H2O。
工业上将生石膏热至150℃脱水成熟石膏(烧石膏)CaSO4·H2O,或(CaSO4)2·H2O,加水又转化为CaSO4·2H2O。据此可用于石膏绷带、制作石膏模型、粉笔、工艺品、建筑材料。
石膏还用为水泥调速剂以控制其硬化速度。油漆腻子、纸张填料也用到石膏,日常点豆腐可用它为凝结剂。农业上施用石膏以降低土壤的碱性。石膏矿与煤炭于高温可制得SO2用于生产硫酸。
CaSO4溶解度不大,其溶解度呈特殊的先升高后降低状况。如10℃溶解度为0.1928克/100克水(下同),40℃为0.2097,100℃降至0.1619,使溶解硫酸钙的硬水在高压锅炉(可达400℃)中结垢,造成危害, 应于事前Na2CO3使CaSO4转化为更难溶的CaCO3沉淀而除去(使硬水软化)。
在大理石遇稀H2SO4时因生成微溶CaSO4覆盖于大理石表面阻碍与酸的接触,使反应停止,故不能用稀H2SO4与大理石制取CO2。
【结构】
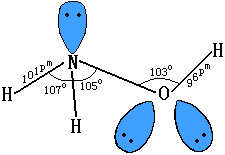
【性质】
纯羟氨是无色固体,熔点305K,不稳定,在288K以上便分解为NH3、N2和H2O
3NH2OH![]() NH3+ N2+ 3H2O
NH3+ N2+ 3H2O
4NH2OH![]() 2NH3+ N2O + 3H2O(部分按此式分解)
2NH3+ N2O + 3H2O(部分按此式分解)
羟氨易溶于水,它的水溶液比较稳定显弱碱性(比联氨还弱).
NH2OH + H2O![]() NH3OH+ + OH- K=6.6×10-9 (298K)
NH3OH+ + OH- K=6.6×10-9 (298K)
它与酸形成盐,常见的盐有[NH3OH]Cl和[NH3OH]2SO4。
将较高氧化态的含氮化合物还原,可制得羟氨,如把亚硝酸盐还原为羟氨的盐.
NH4NO2+ NH4HSO3+ SO2+ 2H2O![]() [NH3OH]+ HSO4- + (NH4)2SO4
[NH3OH]+ HSO4- + (NH4)2SO4
羟氨既有还原性又有氧化性,但它主要用作还原剂。羟氨与联氨作为还原剂的优点,一方面是它们具有强的还原性,另一方面是它们的氧化产物主要是气体(N2,N2O,NO),可以脱离反应体系,不会给反应体系带来杂质。
【一氧化二氮】俗称笑气。化学式N2O, 式量44.02。无色气体, 有微甜气味和微甜味道。密度1.977克/升, 熔点-90.8℃, 沸点-88.5℃。溶于水和乙醇, 但不与水反应。室温时不活动。加热至500℃以上分解为氮气和氧气。高温时跟碱金属及许多有机物反应。有麻醉作用, 吸入极少量时刺激面神经使人发笑。用作外科或牙科的麻醉剂及食物溶胶。用硝酸铵在熔融状态下分解制得。
【三氧化硫】又称硫酸酐, 化学式SO3。式量SO3为80.06。无色固体, 易挥发。熔点16.8℃, 沸点44.8℃。密度2.29克/厘米3 (-10℃)。液体密度1.92克/厘米3 (20℃)。蒸气状态的分子为平面三角形。固态时有三种变体, 较重要的有α型和β型。α型是冰状结构的三聚体(SO3)3 , β型是与石棉结构相似的(SO3)n 结构。极易吸水, 溶于水生成硫酸, 并放出大量热。在空气中强烈冒“烟”。溶于浓硫酸生成发烟硫酸。是酸性氧化物, 跟氧化镁反应放热发强白光。有强氧化性是强氧化剂, 高温时氧化磷, 生成五氧化二磷和二氧化硫, 氧化碘化钾, 生成碘和亚硫酸钾。用于制硫酸、氯磺酸及有机化合物的磺化。将二氧化硫和氧气在五氧化二钒催化作用下制得。
在室温下三氧化硫是一种无色的易挥发固体,熔点289.8K、沸点317K。它是一个强氧化剂,特别在高温时它能氧化磷、碘化钾和铁、锌等金属:
5S03 + 2P ![]() 5SO2 + P2O5
5SO2 + P2O5
2KI + SO3![]() K2SO3 + I2
K2SO3 + I2
三氧化硫极易吸收水分,在空气中强烈冒烟,溶于水中即生成硫酸并放出大量热。这大量热使水蒸发,所产生的水蒸气与SO3形成酸雾,影响吸收的效果,所以工业上生产硫酸不是用水去吸收S03,而是用浓硫酸吸收SO3。将SO3溶解在浓硫酸中所生成的溶液称为发烟硫酸。当它暴露于空气中时,挥发出来的SO3和空气中的水蒸气形成硫酸的细小露滴而冒烟,所以称为发烟硫酸。通常以游离SO3的含量来标明不同浓度的发烟硫酸,如20%、40%等发烟硫酸即表示在100%硫酸中含有20%或40%游离的SO3。
【连二亚硫酸钠】又称保险粉。在空气中极易被氧化,不便于使用,经酒精和浓NaOH共热后,就成为比较稳定的无水盐。
Na2S2O4是一种白色固体,加热至402K即分解:
2Na2S2O4![]() Na2S2O3 + Na2SO3 + SO2
Na2S2O3 + Na2SO3 + SO2
从硫的电势图可见,Na2S2O4是一个很强的还原剂,它的水溶液在空气中放置能被空气中的氧氧化,生成亚硫酸盐或硫酸盐,因此,Na2S2O4在气体分析中用来吸收氧气:
2Na2S2O4 + O2 + 2H2O ![]() 4NaHSO3
4NaHSO3
Na2S2O4 + O2 + H2O ![]() NaHSO3 + NaHSO4
NaHSO3 + NaHSO4
Na2S2O4是印染工业中非常重要的还原剂,有许多有机染料都能被它还原,它还用于染料合成、造纸、保存食物和医学等部门。
【焦硫酸】一种无色的晶状固体、熔点308K。当冷却发烟硫酸时, 可以析出焦硫酸晶体。
焦硫酸可看作是由两分子硫酸脱去一分子水所得的产物:
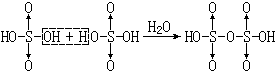 |
焦硫酸与水反应又生成H2SO4。焦硫酸具有比浓硫酸更强的氧化性,吸水性和腐蚀性,在制造某些染料、炸药中用作脱水剂。
将碱金属的酸式硫酸盐加热到熔点以上,可得焦硫酸盐。
2KHSO4 ![]() K2S2O7 + H2O
K2S2O7 + H2O
进一步加热,分解为K2SO4和SO3
K2S2O7 ![]() K2SO4 + SO3
K2SO4 + SO3
焦硫酸盐在无机合成上的一个重要用途是与一些难熔的碱性金属氧化物(如Fe2O3,Al2O3,TiO2等)共熔生成可溶性的硫酸盐。
Fe2O3 + 3K2S2O7 ![]() Fe2(SO4)3 + 3K2SO4
Fe2(SO4)3 + 3K2SO4
Al2O3 + 3K2S2O7 ![]() Al2(SO4)3 + 3K2SO4
Al2(SO4)3 + 3K2SO4
【过硫酸】可以看成是过氧化氢中氢原子被HSO3- 取代的产物。HO·OH中一个H被HSO3- 取代后得HO·OSO3H,即过一硫酸;另一个H也被HSO3- 取代后,得HSO3O0·0SO3H,即过二硫酸,它的结构式见表12-4。
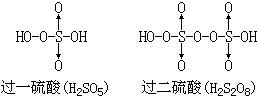 |
过二硫酸是无色晶体,在338K时熔化并分解,具有极强的氧化性,它不仅能使纸炭化,还能烧焦石蜡。
所有的过硫酸盐都是强氧化剂。例如,过硫酸钾和铜能按下式反应:
Cu + K2S2O8 ![]() CuSO4 + K2SO4
CuSO4 + K2SO4
过硫酸盐在Ag+ 离子的作用下,能将Mn2+ 氧化成MnO4- 离子:
2Mn2+ + 5S2O82- + 8H2O ![]() 2Mn04- + 10S042- + 16H+
2Mn04- + 10S042- + 16H+
在钢铁分析中常用过硫酸铵(或过硫酸钾)氧化法测定钢中锰的含量。
应该指出,过二硫酸及其盐作为氧化剂在氧化还原反应过程,它的过氧链断裂,其中两个氧原子的氧化数从-Ⅰ降到-Ⅱ,而硫的氧化数不变仍然是+Ⅵ。
过硫酸及其盐都是不稳定的,在加热时容易分解,例如,K2S2O8受热时会放出SO3和O2:
2K2S2O8 ![]() 2K2SO4 + 2SO3 + O2
2K2SO4 + 2SO3 + O2
【硫酸】化学式H2SO4 , 式量98.08。纯硫酸为无色油状液体。市售浓硫酸含H2SO4 96~98%,密度1.841克/厘米3 。凝固点10.4℃,沸点338℃(98.3%)浓硫酸有强烈吸水性,能与水以任意比混溶, 并放出大量热,这是水合作用的结果。用水稀释浓硫酸时, 只能在搅拌下将浓硫酸徐徐注入水中,切勿将水注入浓硫酸中。有强烈脱水性, 从有机物中按水的组成夺取氢、氧原子,并能使某些有机物碳化。硫酸是二元强酸, 纯硫酸中存在大量未电离分子,几乎不导电。它的水溶液导电, 第一步电离完全,第二步电离不完全K2 =1.2×10-2 。稀硫酸具有酸的通性,其中H+ 也有氧化性。浓硫酸有强氧化性,可以氧化金、铂等以外的大多数金属和许多非金属。
铁、铝、铬等在冷、浓硫酸中发生钝化。浓硫酸将H2S氧化析出硫, 将NaBr氧化生成溴, 将KI氧化生成碘。跟苯等有机物发生磺化反应。硫酸是化学工业中最重要的产品之一, 广泛用于生产化肥、农药、染料、炸药、人造纤维、精炼石油、冶金、金属加工、有机合成、铀矿加工等。工业上用接触法或铅室法制硫酸。接触法是以硫或黄铁矿(FeS2 )为原料, 在空气中燃烧生成二氧化硫, 在五氧化二钒催化剂作用下, 二氧化硫被氧化生成三氧化硫, 用98.3%的硫酸吸收三氧化硫, 再用水稀释制得。
【硫化氢】化学式H2S, 式量34.08, 有腐卵臭味的无色气体,有毒。分子结构与水相似, 呈V形,有极性。密度1.539克/升,熔点-85.5℃, 沸点-60.7℃。能溶于水,水溶液叫氢硫酸, 还能溶于乙醇和甘油。完全干燥的硫化氢常温下不与空气中氧气反应,点火时可燃烧、有蓝色火焰。空气充足时生成二氧化硫和水,若空气不足或温度较低时生成硫和水。能使银、铜制品表面变黑,生成金属硫化物。有较强的还原性, 跟二氧化硫反应生成硫和水,跟浓硫酸反应生二氧化硫和硫, 跟氯气反应生成硫和氯化氢,跟三价铁盐溶液生成二价铁盐和硫, 使硝酸还原为二氧化氮,使I2 还原为I- ,使MnO4- 还原为Mn2+ ,反应中H2S通常被氧化为S, 若氧化剂氧化性较强并过量时,H2S还可能被氧化成H2SO4。H2S能跟多种金属离子反应可成不溶于水和酸的硫化物沉淀。用于分离和鉴定金属离子,精制盐酸, 制备单质硫。由硫化亚铁跟盐酸或用硫蒸气跟氢气化合制备。
【氢硫酸】化学式H2S, 式量34.08, 硫化氢的水溶液叫氢硫酸,有腐卵臭味。是很弱的酸, 在18℃时的电离常数为:K1=9.1×10-8 , K2=1.1×10-12 。在空气中易被氧化析出硫,溶液变浑浊。
【水】分子式为H2O, 水在地球表面上分布最广, 约占地球表面的3/4, 大气中含有水蒸气, 土壤、岩石、动植物体中也含有大量的水, 动物体中的水约占70%, 新鲜植物体中的水分约占80~90%, 地球上水的含量约有2×1018 吨。
18世纪以前, 人们认为水是一种单质, 1781年英国化学家卡文迪许首先发现氢气在空气中燃烧生成的唯一产物是水, 证明水是由氢、氧两种元素组成的化合物。几年以后, 拉瓦锡测定了水的质量组成。近代结构理论证明, 水分子呈V(形结构)。用x射线测定水的晶体(冰)结构, 证明两个O—H键间形成104.5°的键角, 由于水分子是不对称结构, 故知水是极性分子。实验还证明, 水分子通过氢键发生缔合, 形成较复杂的分子集团, 水沸腾时水蒸气中含有3.5%的双分子水(H2O)2, 液态水中含有较复杂的(H2O)n分子(n可以是2、3、4…), 这些较复杂的缔合水分子的化学性质和水(H2O)相同。
纯水是无色、无嗅、无味的液体, 深层的天然水呈蓝绿色。水的热容为4.1868焦尔/克·度(1卡/克·度), 在所有液态和固态物质中, 水的热容最大。水在4℃时密度为1克/厘米3 。在101325帕(1大气压)时, 水的沸点为100℃, 水的气化热为2.257千焦/克, 凝固点是0℃。水是极弱的电解质, 可发生自偶离解:
H2O+H2O H3O+ +OH-
H3O+ +OH-
常温下, 水的电离常数为1.8×10-16 , 水的离子积Kw=1×10-14 。
水是较稳定的化合物, 在1000℃以上才开始分解。在硫酸或氢氧化钠等存在条件下, 电解水可生成氢气和氧气。许多活动性强的金属如K、Na、Ba、Ca等在常温下可跟水反应生成碱和氢气, Mg、Al在加热至水沸腾时跟水反应生成碱和氢气。水可跟许多较活动金属如锌、铁等在高温下反应生成金属氧化物和氢气。水可跟某些非金属反应, 如:
2F2+2H2O=4HF+O2↑
Cl2+H2O HCl+HClO
HCl+HClO
C+H2O CO+H2
CO+H2
水可以跟许多碱性氧化物如K2O、Na2O、CaO、BaO、MgO等化合生成碱, 水可以和多种酸性氧化物SO3、SO2、CO2、P2O5等化合生成相应的酸。水还能跟某些盐或酯、糖等有机物发生水解反应。
水是一种广泛应用的溶剂, 极性物质(如HCl、NaCl等)容易在水中溶解。
【白磷】 化学式为P4,白色腊状具大蒜气味的固体,放久变黄。极毒(成人误服50毫克/千克可致死)。密度1.82(20℃)克/厘米3 ,熔点44.1℃,沸点 280℃,难溶于水,溶于苯、乙醇,易溶于CS2。在空气中可发绿色磷光。易自然,着火点仅34℃,必须贮存在水中(切割时也应在水下进行)。化学活拨性比红磷大。以还原性为主,与卤素、硫、氧反应时皆为还原剂。在强碱中能发生歧化反应:
P4+3NaOH+3H2O =PH3↑+3NaH2PO2(次磷酸钠)
用此法可制PH3但副产物为自然的联瞵P2H4,而制得的PH3也能自燃。白磷在常温下可以与CuSO4溶液发生反应:
2P+5CuSO4+8H2O =5Cu+2H3PO4+5H2SO4
如不小心把白磷沾到皮肤上,用CuSO4溶液冲洗即利用这一反应。加热时反应变为:
11P+15CuSO4+24H2O =5Cu3P+6H3PO4+15H2SO4
白磷主要用于生产磷酸、三氯化磷、三氯氧磷(POCl3)和五硫化二磷等,供农药生产使用。少量白磷用于生产红磷和磷酐,军事上用于烟幕弹,曳光弹、信号弹、燃烧弹。一般用磷矿粉、砂、焦炭于电炉中制取:
2Ca3(PO4)2+10C+6SiO2 P4+6CaSiO3+10CO↑
P4+6CaSiO3+10CO↑
白磷为制红磷与黑磷的原料,隔绝空气加热则缓缓转化为红磷,在较高温(220℃)和高压条件下则渐渐转变为黑磷。
白磷为正四面体分子,由四个磷原子构成,键角为60°,与五原子构成的正四面体分子键角109°28'不同。