|
1.
工业制法:
工业上由矿石中回收和提纯镍的方法主要有三种。
1) 电解冶金法
将富集镍的硫化物矿石焙烧成氧化物,经火法还原,得到金属镍并铸成镍阳极,经电解,在阴极得到高纯度的镍。
2) 化学还原法
将镍的氧化物矿石经过化学浸出,分离共存元素,得到较纯的氧化镍,然后用氢气在一定的压力和温度下还原氧化镍,便得到金属镍。
3) 羰基化法
将镍的硫化物矿与CO反应,生成挥发性的四羰基合镍Ni(CO)4,Ni(CO)4经过加热分解成CO和镍,所得产物纯度高,不含钴。
Ni(CO)4  Ni
+ 4CO↑
Ni
+ 4CO↑

在隔绝空气的条件下,加热镍(Ⅱ)的草酸盐,碳酸盐或硝酸盐,可制得暗绿色的NiO:
|
NiC2O4 |
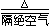
|
NiO + CO↑+ CO2↑
|
|
NiCO3 |

|
NiO + CO2↑
|

向Ni2+的溶液中加入碱,可得绿色的Ni(OH)2沉淀:
Ni2+
+ 2OH-  Ni(OH)2↓(绿色) Ni(OH)2↓(绿色)

在空气中加热分解镍(Ⅱ)的碳酸盐、草酸盐或硝酸盐,或于673K加热NiO,均可以生成黑色的氧化高镍,也称为三氧化二镍:
4NiCO3 + O2  2Ni2O3
+ 4CO2
2Ni2O3
+ 4CO2
4NiO
+ O2  2Ni2O3 2Ni2O3
在碱性溶液中用Br2氧化Ni(OH)2,也可以得到黑色的Ni2O3·2H2O固体:
2Ni(OH)2 + Br2 + 2OH-  Ni2O3
+ 2Br- + 3H2O
Ni2O3
+ 2Br- + 3H2O

向镍(Ⅱ)盐的碱性溶液中加入强氧化剂(如NaOCl、Br2等),或用强氧化剂氧化Ni(OH)2,都可以得到黑色的氢氧化高镍Ni(OH)3沉淀;
2Ni2+ + 6OH- + Br2  2Ni(OH)3↓
+ 2Br-
2Ni(OH)3↓
+ 2Br-
2Ni(OH)2 + NaOCl + H2O
 2Ni(OH)3↓
+ NaCl 2Ni(OH)3↓
+ NaCl

1.
工业制备:
工业上常用金属镍法和含镍废料法制得。
1) 金属镍铁法是将用水冲净的镍板和一定量水,放入反应器内后,逐渐加入浓HNO3,并控制反应速率平稳,用蒸气加热,使反应温度达323~333K,直至黄色烟雾全部消失。
|
3Ni
+ 8HNO3 |
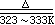
|
3Ni(NO3)2
+ 2NO↑+ 4H2O
|
反应液加水稀释,用NiCO3调节pH值为5~6。滤去杂质,用硝酸硝化清液至pH值为3~4。清液经减压蒸馏、浓缩、冷却、结晶。晶体经离心脱水,即得硝酸镍。
2) 含镍废料法是用含镍废料(如电镀液等)为原料,先制得NiCl2,然后碱化形成粗制的氢氧化镍,再经硝酸作用,生成硝酸镍。

用氧化镍,氢氧化镍或碳酸镍与HCl反应,可得到NiCl2·6H2O的绿色晶体:
NiO + 2HCl  NiCl2
+ H2O NiCl2
+ H2O
NiCO3 + 2HCl
 NiCl2
+ H2O + CO2 NiCl2
+ H2O + CO2

硫酸镍可通过下列反应制取:
2Ni + 2HNO3 +
2H2SO4  2NiSO4
+ NO2 + NO + 3H2O 2NiSO4
+ NO2 + NO + 3H2O
NiO + H2SO4(稀)
 NiSO4
+ H2O NiSO4
+ H2O
NiCO3 + H2SO4(稀)
 NiSO4
+ CO2 + H2O NiSO4
+ CO2 + H2O
蒸发,浓缩溶液可析出绿色NiSO4·7H2O晶体.

镍粉在325K及常压下就可与CO反应生成[Ni(CO)4].
|
Ni + 4CO |
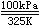
|
[Ni(CO)4] |

|