|
单质铁的制备一般采用冶炼法。以赤铁矿Fe2O3和磁铁矿Fe3O4为原料,与焦炭和助溶剂在熔矿炉内反应,焦炭燃烧产生CO2气,CO2气与过量的焦炭接触就生成CO气,CO气和氧化铁作用就生成金属铁:
C + O2 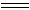 CO2
CO2
CO2 +
C 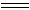 2CO 2CO
Fe3O4
+ CO 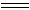 3Fe + CO2 3Fe + CO2
Fe2O3
+ CO 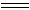 2FeO + CO2 2FeO + CO2
FeO + CO 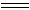 Fe
+ CO2
Fe
+ CO2
以上反应都是可逆反应,所产生的CO气浓度越大越好,要使反应进行完全,必须在800℃以上进行。
化学纯的铁是用氧气还原纯氧化铁来制取,也可由羧基合铁来制取,也可由羧基合铁热分解来得到纯铁。

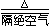
在隔绝空气下,加热亚铁的草酸盐或碳酸盐可制得黑色的FeO:
|
FeC2O4 |
|
FeO + CO↑+ CO2↑
|

1.
工业制法:
将硝酸铁或草酸铁加热,可得α型的Fe2O3,将FeO氧化,所得产物为γ型Fe2O3。
|
Fe(NO3)3 |

|
Fe2O3 + NO2↑+
O2↑
|
2.
实验室制备:
用氢氧化铁加热可得到Fe2O3:
2Fe(OH)3  Fe2O3 +
3H2O Fe2O3 +
3H2O

铁除了生成FeO和Fe2O3之外,还生成一种FeO和Fe2O3的混合氧化物—Fe3O4,亦称为磁性氧化铁。它具有磁性,是电的良导体,是磁铁矿的主要成分。
将铁或氧化亚铁在空气中加热,或令水蒸气通过烧热的铁,都可以得到Fe3O4:
3Fe + 2O2 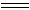 Fe3O4
Fe3O4
6FeO + O2 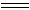 2Fe3O4
2Fe3O4
3Fe + 4H2O
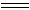 Fe3O4
+ 4H2 Fe3O4
+ 4H2
也可用Fe2O3通过高温灼烧制取Fe3O4:
|
6Fe2O3 |

|
4Fe3O4
+ O2↑
|

将铁的二价盐与强碱作用,可制得氢氧化亚铁。
Fe2+ +
2OH- 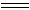 Fe(OH)2↓(白色) Fe(OH)2↓(白色)

1.
工业制备:
硫酸亚铁的工业制法有以下几种:
1) 用氧化黄铁矿FeS2的方法制取:
2FeS2 +
7O2 + 2H2O 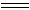 2FeSO4
+ 2H2SO4 2FeSO4
+ 2H2SO4
2) 由Fe2O3制取Fe2(SO4)3,由Fe2(SO4)3和Fe的氧化还原反应制取硫酸亚铁:
Fe2O3
+ 3H2SO4 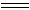 Fe2(SO4)3
+ 3H2O
Fe2(SO4)3
+ 3H2O
Fe2(SO4)3
+ Fe 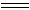 3FeSO4 3FeSO4
3) 将废铁片、铁丝等溶于硫酸,使之发生反应.生成物呈微酸性,经澄清除杂,再经冷却结晶、离心脱水、洗涤等步骤后,即可获得含七份结晶水的蓝绿色、单斜晶型的硫酸亚铁晶体。
Fe + H2SO4 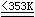 FeSO4
+ H2↑
FeSO4
+ H2↑
4)
工业上也常将FeSO4作为生产钛白的副产品。将钛铁矿用硫酸分解后,分出生成的副产品FeSO4。然后冷却,结晶,也可制得FeSO4·7H2O。
FeTiO3 +
2H2SO4 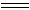 TiOSO4
+ FeSO4 + 2H2O TiOSO4
+ FeSO4 + 2H2O

1.
工业制法:
(1) 无水三氯化铁: 工业上制备固体无水三氯化铁的方法有氯化法和四氯化钛副产法。
氯化法是以废铁丝或铁片为原料,与在反应炉中逆流而上的氯气反应,制得无水FeCl3。
2Fe + 3Cl2 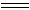 2FeCl3 2FeCl3
该反应为放热反应。若温度过高会使产物局部分解,形成FeCl2和Cl2,降低了产品的得率和纯度。因而,工艺流程中要用循环冷却水带走反应中多余的热量。FeCl3蒸气由炉顶排出,经冷凝得FeCl3。
也可利用在生产四氯化钛时的副产品固体作原料制备FeCl3。但该法所得产品纯度较差。
(2) 六水合三氯化铁: 将铁屑溶于盐酸中,再往溶液中通入氯气,经浓缩、冷却,就有黄棕色的六水合三氯化铁FeCl3·6H2O(或写成[Fe(H2O)6]·Cl3)晶体析出:
Fe + 2HCl 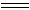 FeCl2
+ H2
FeCl2
+ H2
2FeCl2 +
Cl2 + 6H2O 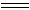 2FeCl3·6H2O 2FeCl3·6H2O
加热六水含三氯化铁晶体,则水解失去HCl而生成碱式盐:
FeCl3·6H2O
 Fe(OH)Cl2
+ HCl Fe(OH)Cl2
+ HCl

将Fe2O3,KNO3和KOH混合加热共融,可以制得紫红色的高铁酸钾盐:
Fe2O3
+ 3KNO3 + 4KOH  2K2FeO4
+ 3KNO2 + 2H2O
2K2FeO4
+ 3KNO2 + 2H2O
或者以NaClO为氧化剂,在碱性介质中,可将新制取的Fe(OH)3氧化至高铁酸盐.
2Fe(OH)3 + 3ClO-
+ 4OH- 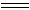 2FeO42-
+ 3Cl- + 5H2O 2FeO42-
+ 3Cl- + 5H2O

用亚铁盐与过量的KCN反应,结晶析出黄色晶体K4[Fe(CN)6]·3H2O:
Fe2+ +
6KCN + 3H2O 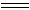 K4[Fe(CN)6]·3H2O
+ 2K+ K4[Fe(CN)6]·3H2O
+ 2K+

用氯气氧化黄血盐,可制得深红色的K3[Fe(CN)6]晶体:
2K4[Fe(CN)6]
+ Cl2 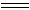 2KCl + 2K3[Fe(CN)6] 2KCl + 2K3[Fe(CN)6]

用新还原的铁粉在20MPa的压力下(约200大气压),373K~473K时通入CO可得到黄色液体[Fe(CO)5].
|
Fe + 5CO |
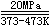
|
[Fe(CO)5] |

|