|
1.
工业制备:
一般以软锰矿为原料,用铝热法或一氧化碳还原法制得。制备过程分两步进行:
1) 将软锰矿加热燃烧成Mn3O4;
2)
将铝粉加入产物,混合并燃烧,即可制得金属锰。
3MnO2  Mn3O4
+ O2 Mn3O4
+ O2
3Mn3O4 + 8Al  9Mn
+ 4Al2O3
9Mn
+ 4Al2O3
制得的锰纯度不高(95%~98%),用电解法可制得纯锰。

1.
工业制备:
工业上用软锰矿制备硫酸锰。将软锰矿粉与煤粉以一定的比例混合,在1073K还原焙烧,先生成MnO。在隔绝空气条件下将产物冷至室温。再用15%~20%稀硫酸酸解。控制溶液pH值<5.2,以除去部分Fe3+,Al3+等不溶物,经压滤、静置、净化、去杂。滤液经蒸发、浓缩、结晶、分离、干燥后,得成品MnSO4·H2O。
MnO + H2SO4 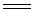 MnSO4·H2O MnSO4·H2O

1.
工业制备:
在Mn(IV)化合物中以MnO2为最重要。软锰矿中的锰即以MnO2形式存在。工业制备方法主要有两种。
1)
电解法:电解法是目前普遍采用的方法。该法是将碳酸锰矿粉和硫酸溶液以一定比例加入反应器,先生成硫酸锰。然后控制溶液pH值为4,加入少量的MnO2矿粉,使溶液中杂质Fe2+离子氧化,并形成Fe(OH)3沉淀除去。
用石灰乳将反应中生成的过量酸中和至pH=7,再加入BaS,沉淀溶液中重金属离子。滤液(含有MnSO4及H2SO4)置于以石墨或钛为阳极,石墨或铅为阴极的电解槽中电解。电解过程中,连续加入中性MnSO4溶液,并不断排除等体积的电解液,以保证电解液成分恒定。电解反应为:
阳极 MnSO4 + 2H2O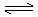 MnO2
+ H2SO4 + 2H+ + 2e MnO2
+ H2SO4 + 2H+ + 2e
阴极 2H+ + 2e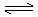 H2↑ H2↑
总反应 MnSO4 + 2H2O 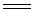 MnO2
+ H2SO4 + H2↑
MnO2
+ H2SO4 + H2↑
电解毕,从阳极上剥离粗的MnO2,经粉碎并用含碳酸氢钠(中和剂)和氯化氨(解胶剂)的水溶液漂洗,至溶液的pH值达5~7,经过滤,热风干燥、粉碎即可得二氧化锰成品。
在电解过程中,有大量硫酸酸雾出现,故必须注意防护。
2)
化学法:化学法制备二氧化锰有硫酸法和硝酸法两种。
硫酸法是将软锰矿粉置于转炉中,于973K至1020K下煅烧,生成Mn2O3。然后,用硫酸浸取,分离除去MnSO4溶液,即可得沉淀物MnO2。
Mn2O3 + H2SO4 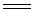 MnO2
+ MnSO4 + H2O
MnO2
+ MnSO4 + H2O
硝酸法是依次用NaOH和HNO3处理上述煅烧产物,即可得产品MnO2,并有副产品产生。

1.
工业制备:
工业上以软锰矿为原料制备锰酸钾。
2MnO2 + 4KOH + O2 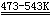 2K2MnO4 + 2H2O
2K2MnO4 + 2H2O
 或
3MnO2 + 6KOH + KClO3 或
3MnO2 + 6KOH + KClO3  3K2MnO4 + KCl + 3H2O
3K2MnO4 + KCl + 3H2O
1.
工业制备:
工业上用碳化法或电解法制备。
1) 碳化法:以软锰矿粉和KOH为原料,先制得K2MnO4溶液。然后用净化的CO2处理溶液,根据MnO42-离子在酸性介质中能歧化的性质,可制得KMnO4溶液。反应如下:
3K2MnO4 + 2CO2 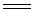 2KMnO4
+ 2K2CO3 + MnO2↓
2KMnO4
+ 2K2CO3 + MnO2↓
工艺流程为:
此法设备简单,耗能少,使用普遍。
2)
电解法:先制得锰酸钾,然后用水或稀溶液浸取,配成内含K2CO3,KOH,K2MnO4等的电解液,在333K时放入表面光滑的镀镍铁为阳极,圆铁条为阴极的铁制电解槽中电解:
2K2MnO4 + 2H2O  2KMnO4
+ 2KOH + H2↑
2KMnO4
+ 2KOH + H2↑
当溶液呈枣红色或紫红色时,停止通电,将电解液转入贮槽内,冷却并分离得高锰酸钾的粗制晶体(含量为94%),粗制品经重结晶可得合格的产品。
电解法所得的母液,经蒸发处理,可回收利用。用水浸取K2MnO4后的废锰,可用作肥料或炼钢用,也可用物理化学方法回收其中的锰。
电解法产品得率较高、成本低。但此法渉及强腐蚀性的KOH,故操作时应十分小心,若溅在皮肤上,应立即用水洗或用硫酸铝或硫酸锌溶液冲洗,再涂上抗坏血酸或硼酸。

|