工业上溴是从海水中制取的(约1t海水可制0.14kg溴),其工艺过程包括置换、碱性条件下歧化、浓缩、酸性条件下逆歧化制得溴.具体步骤为:
1) 将氯气通入pH为3.5的海水中(置换):
|
Cl2 + 2Br- Br2
+ 2Cl- Br2
+ 2Cl-
|
2) 用压缩空气吹出Br2,并在碱性下发生歧化:
|
3Br2 + 3CO32- 5Br-
+ BrO3- +
3CO2↑ 5Br-
+ BrO3- +
3CO2↑
|
3) 浓缩溶液后,在酸性条件下令溶液逆歧化:
|
5Br- + BrO3-
+ 6H+ Br2
+ 3H2O Br2
+ 3H2O
|

|
1. 工业制法:
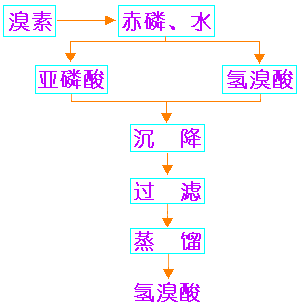
工业上常用赤(红)磷法制的氢溴酸。生产流程如右图11-4所示。
2.
实验室制备:
在实验室中,在红磷与少量水的混合物中缓慢地加入溴,也可产生HBr。
2P+3Br2+6H2O 2H3PO3+6HBr↑ 2H3PO3+6HBr↑
用非氧化性、高沸点的H3PO4,也可制得HBr。
NaBr+H3PO4(浓) NaH2PO4+6HBr NaH2PO4+6HBr |
|
|
图11-4 氢溴酸的工业制法 |

(1)将溴酸钡与硫酸作用:
Ba(BrO3)2 + H2SO4  2HBrO3 + BaSO4↓
2HBrO3 + BaSO4↓
(2)将氯气通入溴水中可得溴酸:
5Cl2 + Br2 + 6H2O  2HBrO3 + 10HCl
2HBrO3 + 10HCl

用单质F2(在碱性溶液)或XeF2氧化BrO3-来制备高溴酸盐,其反应如下:
NaBrO3 + F2
+ 2NaOH  NaBrO4 + 2NaF + H2O
NaBrO4 + 2NaF + H2O
NaBrO3 + XeF2
+ H2O  NaBrO4 + Xe + 2HF↑
NaBrO4 + Xe + 2HF↑

碘主要以碘化物存在于海水中或以碘酸盐的形式存在于硝石中。
由海水制备碘时,将溶液过滤除去泥浆等机械杂质,然后加H2SO4煮沸以沉淀SiO2,溶液中的I-用NaNO2氧化析出I2,并用活性炭吸附,活性炭用NaOH溶液处理使I2歧化为NaI和NaIO3,经H2SO4酸化后析出I2,有关反应方程式如下:
|
2NO2- + 2I-
+ H+ I2
+ 2NO + 2H2O I2
+ 2NO + 2H2O
|
|
3I2 + 6OH- 5I-
+ IO3- + 3H2O 5I-
+ IO3- + 3H2O
|
|
5I- + IO3-
+ 6H+ 3I2
+ 3H2O 3I2
+ 3H2O
|
从生硝中结晶出NaNO3以后,其母液中含有0.6%-1.2%的NaIO3,可用HSO3-将IO3-还原析出I2。
|
2IO3- + 5HSO3- 3HSO4-
+ 2SO42- + I2
+ H2O 3HSO4-
+ 2SO42- + I2
+ H2O
|
该反应实际上是分两步进行的:
|
2IO3- + 6HSO3- 2I-
+ 6SO42- + 6H+ (慢) 2I-
+ 6SO42- + 6H+ (慢)
|
|
IO3- + 5I- + 6H+ 3I2 +
3H2O (快) 3I2 +
3H2O (快)
|
由于HSO3-可将I2还原为I-,反应中HSO3-不能过量,HSO3-与IO3-的物质的量的比例控制在5:6。
可用水蒸气蒸馏或升华的方法将碘纯化,其纯度可达99.5%。

以水滴到非金属卤化物如PI3上,HI则源源不断地发生:
PI3 + 3H2O  H3PO3 + 3HI↑
H3PO3 + 3HI↑
或者把水逐滴加入磷和碘的混合物中即可连续地产生HI气体.
2P + 6H2O + 3I2
 2H3PO3 + 6HI↑
2H3PO3 + 6HI↑
或者: I2 + H2S  2HI + S
2HI + S
I2
+ H2SO3 + H2O  2HI + H2SO4
2HI + H2SO4

1.
碘酸的制备:
用氧化剂将单质碘氧化为碘酸。
10HNO3(浓) + I2  2HIO3 + 10NO2 + 4H2O
2HIO3 + 10NO2 + 4H2O
5Cl2 + I2 + 6H2O  2HIO3 + 10HCl
2HIO3 + 10HCl
2.
碘酸盐的制备:
单质碘在浓碱液中歧化可制得碘酸盐:
6NaOH + 3I2  NaIO3 + 5NaI + 3H2O
NaIO3 + 5NaI + 3H2O
氯气在碱性介质中氧化碘化物可制得碘酸盐:
3Cl2 + KI + 6KOH  KIO3
+ 6KCl + 3H2O
KIO3
+ 6KCl + 3H2O

1. 高碘酸的制备:
用硫酸与高碘酸钡作用可以制得高碘酸:
Ba5(IO6)2 + 5H2SO4
 2H5IO6 +
5BaSO4
2H5IO6 +
5BaSO4
2.
高碘酸盐的制备:
在碱性的碘酸盐溶液中通入Cl2,可得到高碘酸盐.
NaIO3 + Cl2
+ 3NaOH  Na2H3IO6 + 2NaCl
Na2H3IO6 + 2NaCl
若在上述Na2H3IO6悬浮液中加入AgNO3溶液,有Ag5IO6黑色沉淀生成,然后再用氯气和水处理Ag5IO6的悬浮液便生成H5IO6.
Na2H3IO6
+ 5AgNO3  Ag5IO6 + 2NaNO3 +
3HNO3
Ag5IO6 + 2NaNO3 +
3HNO3
4Ag5IO6
+ 10Cl2 + 10H2O  4H5IO6 +
20AgCl + 5O2
4H5IO6 +
20AgCl + 5O2
