|
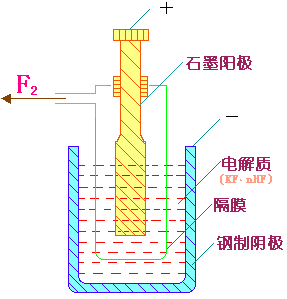
由于氟是活性最强的非金属,所以只能用电解法制备。电解时用石墨作阳极,钢或软钢作阴极并作电解槽的材料,装置见图11-1所示。因为在钢槽表面致密的氟化物保护层的生成可使电解槽不致于进一步被腐蚀。电解质是KF·nHF(用浓硫酸处理萤石粉制得HF)。
阴极反应:2F- - 2e  F2
F2
阳极反应:2HF2- + 2e  H2 + 4F-
H2 + 4F-
电解反应:2HF2-  H2 + F2 +
2F-
H2 + F2 +
2F- |
|
|
图11-1 单质氟的电解装置图 |
在组成为KF·2HF的电解混合物中,电解反应的温度为95~100℃,反应的过程消耗HF,所以要不断补充HF。由于产物H2和F2相遇回爆炸,所以阴阳极要用钢网或铜镍合金隔开。但电解产物F2中含有少量HF是不可避免的。

以萤石和浓硫酸作用是制取氟化氢的主要方法.HF溶于水即为氢氟酸.
|
CaF2 + H2SO4(浓) |

|
CaSO4
+ 2HF↑ |
工业上把反应物放在衬铅的铁制容器中进行(因生成的PbF2保护层阻止进一步腐蚀铁).氢氟酸一般用塑料制容器盛装.试剂级氢氟酸比重为1.14,浓度40%,约22.5mol/L.

把单质氟通入2%NaOH溶液中可制得OF2:
2F2 + 2NaOH  2NaF + H2O + OF2↑
2NaF + H2O + OF2↑

在实验室中氯气的制备是以常见氧化剂(如MnO2,KMnO4,K2Cr2O7)与HCl溶液反应制备,由于氧化剂电极电位数值上的差异,所需盐酸浓度不同。
对于MnO2,需用≥8mol.dm-3浓盐酸,且需加热,因为φΦ(MnO2/Mn2+)=1.208V
|
MnO2 + 4HCl  MnCl2 + 2H2O
+ 2Cl2
MnCl2 + 2H2O
+ 2Cl2
|
对于K2Cr2O7,需用≥6mol.dm-3盐酸,并适当加热,因为φΦ(Cr2O72-/Cr3+)=1.33V
|
Cr2O72-
+ 14H+ + 6Cl- 2Cr3+
+ 7H2O + 3Cl2↑ 2Cr3+
+ 7H2O + 3Cl2↑
|
对于KMnO4,一般≥2mol.dm-3稀盐酸条件下即可进行,因为φΦ(MnO4-/Mn2+)=1.49V
|
MnO4-
+ 10Cl- + 16H+ 2Mn2+
+ 5Cl2 ↑
+ 8H2O 2Mn2+
+ 5Cl2 ↑
+ 8H2O
|
反应的条件很容易根据Nernst方程计算出来。由以上反应可以看出,酸性的增强,有利于氧化反应的进行,并可显著提高氧化剂的氧化能力。
|
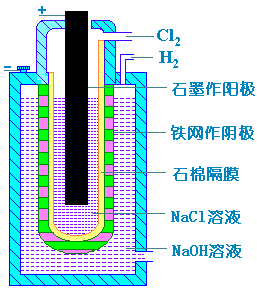
在工业上,氯的制备可以采用电解氯化钠水溶液的方法。虽然在φ-pH图中,氯位于氧区,但由于氯氧化水的速度十分缓慢,因此可采用电解NaCl水溶液的方法。
阳极反应:2Cl- - 2e Cl2 Cl2
阴极反应:2H2O + 2e H2↑+ 2OH- H2↑+ 2OH-
总反应:
2NaCl+2H2O H2↑+Cl2↑+2NaOH H2↑+Cl2↑+2NaOH
|
|
|
图11-2 单质氯的电解装置图
|
从电极电位数值来看,阳极上还会发生另一个反应,即4OH-
-
4e O2
+ 2H2O,φΦ(O2/OH-)=0.40V。对比φΦ(Cl2/Cl-)=1.36V,OH-应先放电,阳极产物似乎是氧气,但实际上是氯气,其原因是电极电位只是标准态下数据,它是在微量电流下(10-9-10-8A)测定的。 O2
+ 2H2O,φΦ(O2/OH-)=0.40V。对比φΦ(Cl2/Cl-)=1.36V,OH-应先放电,阳极产物似乎是氧气,但实际上是氯气,其原因是电极电位只是标准态下数据,它是在微量电流下(10-9-10-8A)测定的。
在实际电解过程中,不可能是标准态下的条件,电极表面附近的离子浓度或低于或高于溶液的整体浓度,造成一定的反电势,以及电解过程的电化学极化等等原因,使电流通过不同电极时的实际分解电压不同,也与理论分解电压不同,这一差值又称超电势(Over
Voltage)。尤其是在电解产物为气态产物时,由于放电速度缓慢等因素,过电位都较大。此外,过电位大小还和气体的种类、电解质的性质和浓度、电极材料及电极表面性质、电流速度、电解温度有关。例如,在以石墨作阳极电解时,25℃,1000A/m2电流密度条件下,Cl-的分解电压为1.7V,而OH-的分解电压为2.0V,因此电解过程实际上是Cl-首先放电,产物是氯气而不是氧气。由此可见,我们不能简单地根据理论计算的电位值来判断反应产物,尤其应注意在电解产物为气体时,过电位的影响。

|
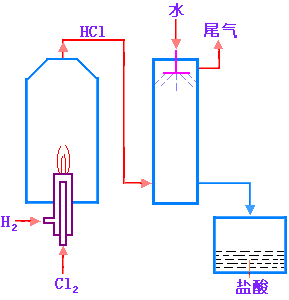
1. 工业制法:
工业制备氯化氢时,首先在反应器中装置双层的燃烧管,将有外管引进的氢气点燃,然后自内管通入氯气,使氯气在氢气中安全燃烧并生成氯化氢气体。产生的氯化氢气体用水吸收而成盐酸。
市售试剂级盐酸比重为1.19,浓度为37%,相当于12mol/L.工业盐酸因含有FeCl3杂质而呈黄色. |
|
|
图11-3 盐酸的工业制备原理图
|
2.
实验室制备:
氯化氢也能用浓H2SO4与NaCl反应制得。反应分两步进行:
第一步是放热反应,而第二步需要加热到773K反应才能进行,所以在实验室一般只能完成第一步反应。

1.
次氯酸钠的制备:
工业上采用无隔膜电解冷的,稀的食盐溶液,并搅动溶液使阳极上所产生的氯气与阴极区所产生的NaOH溶液反应而制得:
|
2Cl-
+ 2H2O |

|
2OH-
+ Cl2↑ + H2↑ |
|
Cl2
+ 2OH- |

|
Cl-
+ ClO- + H2O |
|
总反应:
Cl- + H2O |

|
ClO-
+ H2↑ |
2.
次氯酸钙的制备:
用氯气与Ca(OH)2反应,控制在298K左右,可得次氯酸钙.
2Cl2 + 2Ca(OH)2
 Ca(ClO)2 + CaCl2 + 2H2O Ca(ClO)2 + CaCl2 + 2H2O
漂白粉为次氯酸钙,氯化钙和氢氧化钙所组成的水合复盐.其反应为:
2Cl2 + 3Ca(OH)2
 Ca(ClO)2·CaCl2·Ca(OH)2·H2O
+ H2O Ca(ClO)2·CaCl2·Ca(OH)2·H2O
+ H2O

1.
氯酸的制备:
(1)氯酸钡与硫酸作用可制得HClO3:
Ba(ClO3)2 + H2SO4  BaSO4↓ + 2HClO3
BaSO4↓ + 2HClO3
(2)将氯气通入溴酸盐的酸性溶液中可得氯酸:
Cl2 + 2BrO3- + 2H+  2HClO3 + Br2
2HClO3 + Br2
2.
氯酸盐的制备:
将氯气通入浓碱液中进行歧化反应可得氯酸盐:
3Cl2 + 6NaOH  NaClO3 + 5NaCl + 3H2O
NaClO3 + 5NaCl + 3H2O
工业上利用KClO3溶解度较小的特点,让NaClO3与KCl进行复分解反应,可得KClO3:
NaClO3 + KCl  KClO3 + NaCl
KClO3 + NaCl

(1)工业上用电解酸化氯酸盐来制备高氯酸,在阳极区生成高氯酸盐,经硫酸酸化后,再减压蒸馏可得市售的72%的HClO4.
|
KClO3 + H2O |

|
KClO4(阳极) + H2↑(阴极) |
(2)用浓硫酸与KClO4作用可制得HClO4
KClO4 + H2SO4  KHSO4 + HClO4
KHSO4 + HClO4

|