|
1.
工业制法:
工业上常以铬铁矿为原料,先制得Na2Cr2O7。然后用热碳还原法制得三氧化二铬(Cr2O3),Cr2O3经铝热法还原,即可制得金属铬。
Na2Cr2O7 + 2C  Cr2O3
+ Na2CO3 + CO↑
Cr2O3
+ Na2CO3 + CO↑
Cr2O3 + 2Al  2Cr
+ Al2O3
2Cr
+ Al2O3
也可以Na2CrO4和Na2S为原料,使之反应,先生成Cr(OH)3,然后加热Cr(OH)3,使它充分分解产生Cr2O3,最后也用铝热法制得金属铬。
另一种方法是电解铬盐溶液(如CrCl3)制备金属铬.

1.
工业制法:
工业上常用的制备方法如下。
1)
热分解法:将重铬酸氨或铬酸酐(CrO3)加热分解,制得色泽较暗的Cr2O3。
(NH4)2Cr2O7  Cr2O3
+ N2↑+ 4H2O
Cr2O3
+ N2↑+ 4H2O
2)
还原法:将铬酸钾(或Na2Cr2O7)与硫磺(或NH4Cl)以一定的比例混合,置于反应炉内点燃:
K2Cr2O7 + S 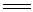 Cr2O3
+ K2SO4
Cr2O3
+ K2SO4
产物经湿磨、热水洗涤、压滤成含水约30~35%的膏状滤饼。滤饼经573K干燥、冷却、粉碎,即可得到六方晶系或无定型的深绿色Cr2O3成品。上述废液中含有有毒的Cr(VI)离子。一般需将Cr(VI)离子转化成Cr(OH)3沉淀的方法处理废水。
3)
工业上也常将含铬废液(如含硫酸铬或氧化铬)经氨水或碱液中和生成Cr(OH)3,加热Cr(OH)3,使之分解成Cr2O3,或用金属铬在氧气中燃烧,直接生成的Cr2O3。

由Cr(Ⅲ)盐溶液与适量碱溶液(如NaOH或氨水)直接反应制得氢氧化铬:
Cr2(SO4)3 + 6NaOH 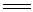 2Cr(OH)3
+ Na2SO4
2Cr(OH)3
+ Na2SO4

在浓硫酸的冷溶液中,加入Cr2O3可制得紫色的硫酸铬Cr2(SO4)3·18H2O,同时伴随有绿色硫酸铬Cr2(SO4)3·6H2O和桃红色的无水硫酸铬。
3H2SO4 + Cr2O3 + 15H2O 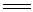 Cr2(SO4)3·18H2O
Cr2(SO4)3·18H2O

若将Cr2(SO4)3与碱金属的硫酸盐(如K2SO4)反应,则可制得紫色或暗紫红色、八面体结晶的铬钾钒KCr(SO4)2·6H2O。
工业上也可用有机物还原法或二氧化硫还原法来制备。前者以K2Cr2O7为原料,经硫酸酸化后,与蔗糖等有机物反应,静置,使生成物缓慢结晶,分离出晶体,经冷水洗涤、低温干燥,即得成品。
8K2Cr2O7 + 32H2SO4 +
C12H22O11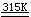 16KCr(SO4)2·12H2O
+ 12CO2 + 31H2O 16KCr(SO4)2·12H2O
+ 12CO2 + 31H2O
而SO2还原法是利用K2Cr2O7与SO2及H2SO4混合液反应的方法制备的。
K2Cr2O7 + 3SO2 + H2SO4
+ 11H2O 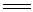 2KCr(SO4)2·12H2O 2KCr(SO4)2·12H2O

将K2Cr2O7(或Na2Cr2O7)和浓硫酸加入钢制反应器中,混和,加热熔融,即可制得暗红色的针状晶体CrO3(又名铬酐)。
K2Cr2O7 + 2H2SO4 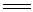 2CrO3↓+
2KHSO4 + H2O
2CrO3↓+
2KHSO4 + H2O
上法称为硫酸法,工业上也可将CaCl2加入Na2CrO4溶液中,经反应制得CaCrO4,经洗涤后,用硫酸分解,产物经分离、浓缩后,即可获得成品CrO3。
CrO3也可用硝酸分解Na2CrO4直接制得或用氟硅酸分解Na2Cr2O7方法制备:
Na2Cr2O7 + H2SiF6 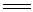 2CrO3
+ Na2SiF6 + H2O
2CrO3
+ Na2SiF6 + H2O

1.
工业制法:
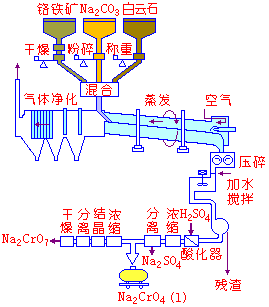
工业上一般均以铬铁矿为原料,先制得铬酸钠,然后转化成重铬酸钠。现以硫酸法为例,介绍Na2Cr2O7的工业制备方法。
将含Al2O3,MgO及SiO2等杂质的铬铁矿[Fe(CrO2)2]粉碎后,与纯碱(Na2CO3),白云石(CaCO3,MgCO3)混合,送入回转窑中,在1273~1423K下氧化焙烧,使铬转化成可溶性的铬酸盐:
4Fe(CrO2)2 + 8Na2CO3 + 7O2
 8Na2CrO4
+ 2Fe2O3 + 8CO2 8Na2CrO4
+ 2Fe2O3 + 8CO2
|
熔块状生成物经冷却粉碎后,用水浸取,并调节pH=7~8,获得包含杂质NaAlO2,Na2SiO3等的溶液。经过滤除铁、铝等杂质后的中性滤液,又经蒸发,并进入酸化器。在酸化器中,用理论量100%~102%的H2SO4酸化,使Na2CrO4转化成Na2Cr2O7。
2Na2CrO4+2H2SO4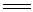 Na2Cr2O7+Na2SO4+H2O Na2Cr2O7+Na2SO4+H2O |
|
|
Na2Cr2O7的生产工艺流程 |
由于Na2Cr2O7的溶解度比Na2SO4大,因此溶液经多次重复蒸发,可完全除去Na2SO4。然后澄清,除去不溶性杂质,澄清液在303~313K时结晶,形成橙红色单斜晶形或针状的Na2Cr2O7结晶,流程见上图.

1.
工业制法:
工业上常用复分解法、铬铁矿熔烧法、铬矿的碳酸钾或苛性钾焙烧法等多种方法制备重铬酸钾。最常用的是复分解法。该法以Na2Cr2O7为原料。将Na2Cr2O7溶液稀释并加热,加入KCl(含量>90%),在378K至383K下进行复分解反应:
Na2Cr2O7 + 2KCl 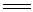 K2Cr2O7
+ 2NaCl
K2Cr2O7
+ 2NaCl
生成的产物中加入少量的NaClO3,并用NaOH调节溶液的pH值为5~6。加入少量的Al2(SO4)3,使杂质絮凝并澄清除去。清液经冷却、结晶、分离、洗涤和干燥后,即可得到橙红色的三斜晶体。产物中的K2Cr2O7和NaCl的分离,是利用两者的溶解度随温度变化的规律不同的特征而达到。从溶解度曲线可知:NaCl的溶解度几乎不随温度变化,而K2Cr2O7在低温时,溶解度较低(如273K时溶解度为4.6g/100gH2O)。随着温度的升高,溶解度会迅速上升。如温度达373K时,溶解度为94.1g/100gH2O。因而,利用先升高温度,后降低温度的措施,可使混合液中析出无水的K2Cr2O7晶体。

将钼酸铵与HCl反应,即可生成钼酸,加热焙烧产物,即得白色粉状的三氧化钼,熔点1070K。
(NH4)2MoO4 + HCl 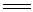 H2MoO4
+ 2NH4Cl
H2MoO4
+ 2NH4Cl
|
H2MoO4 |

|
MoO3
+ H2O
|
若在钨酸钠溶液中加入盐酸,则可生成钨酸沉淀,将沉淀加热脱水,即可生成淡黄色、粉状的三氧化钨,熔点1450K。
Na2WO4
+ HCl 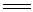 H2WO4 +
2NaCl H2WO4 +
2NaCl
H2WO4  WO3
+ H2O
WO3
+ H2O

钼酸盐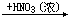 H2MoO4·H2O(黄色) H2MoO4·H2O(黄色) H2MoO4(白色) H2MoO4(白色)
|
钨酸盐 |
{
|

|
H2WO4(黄色)
|
|

|
H2WO4·xH2O(胶体)(白色) H2WO4(黄色) H2WO4(黄色)
|

|