|
1.
工业制法:
(1)从黄铁矿提取硫:
3FeS2 + 12C + 8O2  Fe3O4 + 12CO + 6S
Fe3O4 + 12CO + 6S
(2)弗拉施法提取硫:
用过热水蒸气加热含硫的矿石使硫熔化,再利用热空气(2-2.5MPa)将液态硫压到地表,硫的纯度可达99.5%。
(3)改良的克劳斯法制备硫:
将H2S催化氧化是制备单质硫的重要途径:
|
2H2S + O2 |
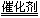
|
2S + 2H2O |
原料来源于天然气和各种工业气体中所含的H2S,催化剂是多孔的氧化铝,三氧化二铁或活性炭。
(4)其他方法:
以冶炼硫化物矿时所产生的SO2为原料,也可制单质硫:
SO2 + 2H2S  3S + 2H2O
3S + 2H2O
SO2 + C  S + CO2 S + CO2
将粗硫蒸馏,可得更纯净的硫。硫蒸气冷却后形成细微结晶的粉状硫,叫做硫华。

(1)硫蒸气与氢气直接化合:
S + H2  H2S H2S
(2)实验室中用金属硫化物与酸作用制备H2S:
FeS + H2SO4  H2S
+ FeSO4 H2S
+ FeSO4
Na2S + H2SO4  H2S + Na2SO4
H2S + Na2SO4
其中,前一反应可用启普发生器用于较小量的H2S气体的制备,后一反应适用于较大量的H2S气体的制备。

Na2S是通过还原天然芒硝来进行大规模工业生产。
(1)用煤粉高温还原Na2SO4:
|
Na2SO4 + 4C |

|
Na2S + 4CO |
(2)用H2高温还原Na2SO4:
|
Na2SO4 + 4H2 |

|
Na2S + 4H2O |

(NH4)2S是将H2S通入氨水中制备的:
2NH3·H2O + H2S  (NH4)2S + 2H2O
(NH4)2S + 2H2O

Na2S或(NH4)2S的溶液能够溶解单质硫而形成相应的多硫化物:
Na2S + (x-1)S  Na2Sx
Na2Sx
(NH4)2S + (x-1)S  (NH4)2Sx
(NH4)2Sx

1.
实验室制法:
实验室中使亚硫酸盐与酸反应制得SO2,但欲制取纯的SO2,需用Cu与浓H2SO4反应:
Na2SO3 + H2SO4(稀) Na2SO4 + SO2 + H2O
Na2SO4 + SO2 + H2O
Cu + 2H2SO4(浓) CuSO4 + SO2 + H2O
CuSO4 + SO2 + H2O
2.
工业制备:
工业上是通过焙烧黄铁矿制取SO2:
S(s) + O2(g)  SO2
△Gθ =-300.2kJ·mol-1
SO2
△Gθ =-300.2kJ·mol-1
3FeS2
+ 8O2 Fe3O4
+ 6SO2
或 4FeS2 + 11O2 Fe3O4
+ 6SO2
或 4FeS2 + 11O2 2Fe2O3
+ SO2 2Fe2O3
+ SO2

工业上大量的三氧化硫可由催化氧化二氧化硫制得:
|
2SO2 + O2 |
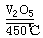
|
2SO3
△Gθ =-70.9kJ·mol-1
|

1.
工业制法:
目前工业上采用接触法生产硫酸,即先通过二氧化硫的催化氧化来制备三氧化硫,用水吸收生成的SO3可制得硫酸。但由于SO3和水反应时放出大量的热,反应生成难于收集的酸雾,所以在硫酸工业上是98.3%的硫酸来吸收SO3,得到含过量20%的发烟硫酸(H2SO4·xSO3)。为了提高转化率,让反应中的气体再经过一次催化氧化和吸收,这样可使SO2转化率提高到本99.7%。同样再用92.5%H2SO4来稀释发烟硫酸,即得到98.3%的商品浓硫酸,其总反应式仍然为:
SO2 + O2 + H2O  H2SO4 △Hmθ =-197.8kJ·mol-1
H2SO4 △Hmθ =-197.8kJ·mol-1

无水Na2SO4又称元明粉。大量用于玻璃、造纸、水玻璃、陶瓷工业,也是制造Na2S和Na2S2O3·5H2O的原料。
Na2SO4(s)
+ 2C 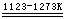 Na2S + 2CO2 Na2S + 2CO2
|
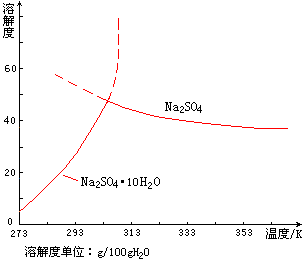
Na2SO4·10H2O称为芒硝。医药上用作泻盐。图11-4是硫酸钠的溶解度曲线。从图看出,Na2SO4与Na2SO4·10H2O的曲线相交于305.4K,如果在305.4K以下结晶时,Na2SO4·10H2O析出。如果在305.4K以上结晶时,Na2SO4析出。305.4K称为Na2SO4与Na2SO4·10H2O在溶液中的转变温度。 |
|
|
图11-4
Na2SO4的溶解度曲线 |
所有的无水盐和它的水合盐在溶液中都有它们自己的转变温度,此温度就是溶解度曲线转折点的地方。水合盐受热失去结晶水可转化为无水盐,相反无水盐在潮湿空气中会吸收水分而成为水合盐。各种水合盐在一定温度下都有自己的蒸气压。例如Na2SO4·10H2O在303K时蒸气压为3599.7Pa。当水合盐的蒸气压大于空气中水蒸气分压时,水合盐就会失去水分而风化,反之就会潮解。所以水合盐的风化既与本身的蒸气压大小有关,也与温度、空气中的湿度有关。

焦硫酸是由等质量的SO3和纯硫酸相化合而制得:
H2SO4 + SO3  H2S2O7
H2S2O7

将碱金属的酸式硫酸盐加热可制得焦硫酸盐:
2NaHSO4  Na2S2O7 + H2O
Na2S2O7 + H2O

将硫粉溶于沸腾的亚硫酸钠碱性溶液中或将Na2S和Na2CO3以2:1的物质的量之比配成溶液再通入SO2便可制得Na2S2O3.
Na2SO3 + S  Na2S2O3
Na2S2O3
2Na2S + Na2CO3 + 4SO2  2Na2S2O3
+ CO2
2Na2S2O3
+ CO2
也可用以下方法制备:
2NaHS + 4NaHSO3  3Na2S2O3
+ 3H2O
3Na2S2O3
+ 3H2O
2Na2S + 3SO2  2Na2S2O3
+ S↓
2Na2S2O3
+ S↓

在没有氧的条件下,用锌粉还原NaHSO3可制得连二亚硫酸钠:
2NaHSO3 + Zn  Na2S2O4 + Zn(OH)2
Na2S2O4 + Zn(OH)2
析出的晶体含有二个结晶水(Na2S2O4·2H2O)。在空气中极易被氧化,不便于使用,经酒精和浓NaOH并热后,就成为比较稳定的无水盐。

工业上用电解硫酸氢盐溶液(也可用K2SO4或(NH4)2SO4在50%H2SO4中的溶液)的方法来制备。电解时在阳极(铂极)上HSO4-离子被氧化生成过二硫酸盐,而在阴极(石墨或铅极)产生氢气。
阳极 2HSO4-  S2O82-
+ 2H+ + 2e-
S2O82-
+ 2H+ + 2e-
阴极 2H+ +
2e-  H2↑
H2↑

制备连多硫酸盐有多种方法,如273K时,在饱和SO2溶液中通入H2S,能得到一种Wachenroder溶液,它是一个复杂的体系,其中有胶状硫、H2S4O6和H2S5O6等,加入KOH浓缩之即有K2S4O6和K2S5O6的晶体生成,根据晶体的比重不同经过处理可将它们分离。
用适当的氧化剂(如H2O2、I2)与硫代硫酸钠反应也可获得连多硫酸盐:
2Na2S2O3
+ 4H2O2  Na2S3O6
+ Na2SO4 + 4H2O Na2S3O6
+ Na2SO4 + 4H2O
至于连二硫酸(H2S2O6)看起来好像是连多硫酸(H2SxO6)同系物中最简单的一员,但连二硫酸及其盐与连多硫酸及其盐在制备方法、氧化性以及进一步结合S原子等方面都显然不同。
如用MnO2氧化亚硫酸,可制得连二硫酸:
MnO2 + 2SO32-
+ 4H+  Mn2+ + S2O62- + 2H2O
Mn2+ + S2O62- + 2H2O
而用H2S还原亚硫酸是制备连多硫酸的一种方法(见上述)。

1.
SOCl2的制备:
用SO2和PCl5反应就可制备出氯化亚硫酰SOCl2:
SO2 +
PCl5  SOCl2 + POCl3
SOCl2 + POCl3 2.
SO2Cl2的制备:
将SO2和氯气通过催化剂(樟脑或活性炭)反应,就能化合生成氯化硫酰SO2Cl2:
SO2 + Cl2  SO2Cl2
SO2Cl2 3.
氯磺酸:
氯磺酸HSO3Cl是用干燥的HCl气体与发烟硫酸作用而得:
SO3 + HCl  HSO3Cl
HSO3Cl 
1.
二氯化二硫S2Cl2的制备:
将干燥氯气通入熔融的硫中可制得S2Cl2:
2S + Cl2
 S2Cl2 S2Cl2 2.
六氟化硫SF6的制备:
硫与氟激烈反应生成SF6:
3F2 + S  SF6
SF6

|