|
利用空气或某些含氧化合物可制备氧气。空气和水是制取氧气的主要原料,大约有97%的氧是从空气中提取的,3%的氧来自电解水。
1. 实验室制备:
由于在氧化物或含氧酸盐中氧的氧化数为-2,所以在实验室中制备氧的基本途径之一是用化学法把O2-氧化成O2。如加热分解金属氧化物或含氧酸盐,其反应为:
2HgO 2Hg + O2 2Hg + O2
2BaO2 2BaO + O2 2BaO + O2
2NaNO3 2NaNO2 +
O2 2NaNO2 +
O2
其中最常用的方法是以二氧化锰为催化剂加热使KClO3分解,分解温度约473K左右。
2.
工业制法:
|
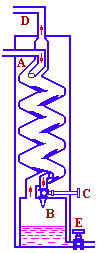
工业上主要是通过物理法液化空气,然后分馏制氧。欲使空气液化,必须先将空气降温到临界温度以下,并加大压力才可以实现。空气的临界温度约为133K,用一般的冷冻剂难以达到这样低的温度,工业上常采用绝热膨胀法来获得低温。当空气被压缩时其体积减小,同时会放出热量。反之,当被压缩的空气膨胀时(既压强减小)其体积增大,温度会剧烈的降低。压强每减小101.3kPa,温度可降低0.25K。若将2×105kPa的气体减压到101.3kPa时,温度可降低50K之多,经多次压缩、膨胀,就能使空气达到液化的温度。装置如图12-1所示. |
|
|
图12-1 空气液化装置 |
将除去灰尘、水蒸气和二氧化碳的空气压缩到2×105kPa,经内管A到达管端,通过减压活塞C并在B内膨胀到101.3kPa,温度较原来可降低50K。冷却的空气经外管D逸出,同时冷却了高压空气,这种冷却了的高压空气再膨胀到101.3kPa,就可使空气进一步降温,如此压缩和膨胀重复多次,空气即可液化。把这个方法所生产的氧压入高压钢瓶中储存,这样便于运输和使用。现在无论在工业上还是在实验室中均用此法生产氧气。此法可以得到纯度高达99.5%的液态氧。

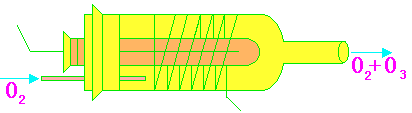
实验室里利用对氧无声放电来获得臭氧。简单臭氧发生器装置如下图12-2所示。主要是由两个玻璃管所组成,其中的一个玻璃管套在另一中间。干燥的氧气在两管之间慢慢通过。导线的两端和高压感应圈的两极相连接。无声放电发生在两管之间,从臭氧发生器中出来的气体中约含3~10%的臭氧。可进一步利用氧和臭氧沸点相差较大(≈70K)的特点,通过分级液化的方法制取更纯净、浓度较高的臭氧。
|
 |
|
图12-2 臭氧发生器装置图
|

1.
实验室制备:
实验室里可用稀硫酸与BaO2或Na2O2反应来制备过氧化氢:
BaO2 + H2SO4 BaSO4↓+ H2O2 BaSO4↓+ H2O2
Na2O2 + H2SO4 + 10H2O2 Na2SO4·10H2O
+ H2O2 Na2SO4·10H2O
+ H2O2
除去沉淀后的溶液含有6~8%的H2O2.
2.
工业制法:
工业上制备过氧化氢的方法有:
1) 电解硫酸氢盐溶液(也可用K2SO4或(NH4)2SO4在50%H2SO4中的溶液)。电解时在阳极(铂极)上HSO4-离子被氧化生成过二硫酸盐,而在阴极(石墨或铅极)产生氢气。
阳极 2HSO4- S2O82-
+ 2H+ + 2e- S2O82-
+ 2H+ + 2e-
阴极 2H+ +
2e- H2↑ H2↑
将电解产物过二硫酸盐进行水解,便得到H2O2溶液.
S2O82-
+ 2H2O H2O2
+ 2HSO4- H2O2
+ 2HSO4-
经减压蒸馏可得到浓度为30~35%的H2O2溶液。
2) 乙基蒽醌法: 以钯为催化剂在苯溶液中用H2还原乙基蒽醌变为蒽醇。当蒽醇被氧氧化时生成原来的蒽醌和过氧化氢。蒽醌可以循环使用。
当反应进行到苯溶液中的过氧化氢浓度为5.5g·L-1时,用水抽取之,便得到18%的过氧化氢水溶液。可以减压蒸馏得到高浓度溶液。本法较电解法为经济。其缺点:①使用钯催化剂费用大,②蒽醌醇经多级降解后成为一种不能循环使用的降解物,故在反应过程中必须不断除去降解物和添加新的蒽醌醇。

|

