|
1.
工业制法:
工业上单质磷是通过磷酸钙矿、砂子和炭粉在电炉中加热到1773K而制得:
2Ca3(PO4)2 + 6SiO2 + 10C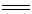 6CaSiO3
+ 10CO↑+ P4↑ 6CaSiO3
+ 10CO↑+ P4↑
将生成的磷蒸气和CO通过冷水,便得到固体白磷。

有多种方法可以制备PH3:
⑴ 磷化钙的水解
Ca3P2 + 6H2O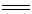 3Ca(OH)2
+ 2PH3 3Ca(OH)2
+ 2PH3
⑵ 碘化磷同碱的反应
PH4I + NaOH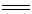 NaI
+ H2O + PH3 NaI
+ H2O + PH3
⑶ 单质磷和氢气的气相反应
P4(g) + 6H2(g)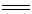 4PH3(g) 4PH3(g)
⑷ 白磷同沸热的碱溶液作用
P4(s) + OH- + 3H2O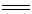 3H2PO2-
+ PH3 3H2PO2-
+ PH3

磷的卤化物有两种类型PX3和PX5,除PF3外,磷的卤化物都能由元素直接化合。但PI5至今尚未制得。
卤化物中以三氯化磷和五氯化磷为最重要。将干燥的氯气通入熔化的磷中,可制得无色液态的三氯化磷:
P4 + 6Cl2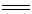 4PCl3 4PCl3
过量的氯气与三氯化磷反应可制得白色固态的五氯化磷:
PCl3 + Cl2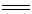 PCl5 PCl5

常见磷的氧化物是P4O6和P4O10两种。当磷在空气不足条件中燃烧时,生成P4O6;在过量的空气中燃烧就可得到P4O10。
P4 +
3O2(不足)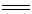 P4O6 P4O6
P4
+ 5O2(过量)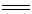 P4O10 P4O10

将白磷溶于热的氢氧化钡溶液,可以得到次磷酸钡,用硫酸使钡离子生成沉淀,就得到自由状态的次磷酸。
2P4 + 3Ba(OH)2 + 6H2O 3Ba(H2PO2)2 +
2PH3↑ 3Ba(H2PO2)2 +
2PH3↑
Ba(H2PO2)2 + H2SO4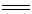 2H3PO2
+ BaSO4↓ 2H3PO2
+ BaSO4↓

P4O6与冷水作用或PCl3水解都能产生亚磷酸。
P4O6 + 6H2O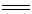 4H3PO4 4H3PO4
PCl3
+ 3H2O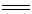 H3PO3
+ 3HCl H3PO3
+ 3HCl

1.
实验室制法:
实验室制备磷酸的方法是30%的HNO3和白磷作用生成纯H3PO4溶液:
3P + 5HNO3 + 2H2O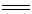 3H3PO4
+ 5NO 3H3PO4
+ 5NO
2.
工业制备:
工业上生产的磷酸是用硫酸和磷酸钙相作用而制得:
Ca3(PO4)2 + 3H2SO4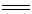 3CaSO4
+ 2H3PO4 3CaSO4
+ 2H3PO4

用H2S处理焦磷酸铜在水中的悬浮液,滤去硫化铜,然后将滤液蒸发结晶就可得到晶状的焦磷酸。
Cu2(P2O7)
+ 2H2S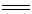 2CuS↓
+ H4P2O7 2CuS↓
+ H4P2O7
磷酸经475~573K强热脱水后,也可制得焦磷酸。
2H3PO4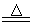 H4P2O7
+ H2O H4P2O7
+ H2O

磷酸加热至673K以上得到偏磷酸(HPO3)x:
xH3PO4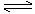 (HPO3)x
+ xH2O (HPO3)x
+ xH2O

|