|
用纯石墨作电极,在氦气氛中放电,电弧中产生的烟炱沉积在水冷反应器的内壁上,这种烟炱中存在着C60、C70等碳原子簇的混合物。用萃取法从烟炱中分离提纯富勒烯,将烟炱放入索氏(Soxhlet)提取器中,用甲苯或苯提取,提取液中的主要成分是C60和C70以及少量C84和C78。再用液相色谱分离法对提取液进行分离,就能得到纯净的C60溶液。C60溶液是紫红色的,蒸发掉溶剂就能得到深红色的C60微晶.

1.
实验室制法:
实验室是用浓H2SO4与甲酸或草酸作用得到:
|
HCOOH CO(g) + H2O CO(g) + H2O
|
|
H2C2O4 CO(g)
+ CO2(g) + H2O CO(g)
+ CO2(g) + H2O
|
后一反应制得的混合气体通过固体氢氧化物除去CO2可得到纯的CO。
2. 工业制备:
工业上大量的CO由发生炉煤气和水煤气得到。将有限的空气通过灼烧的碳层产生发生炉煤气,其成分主要是N2、CO和少量H2、CH4和O2:
2C(s) + O2(g)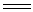 2CO(g) 2CO(g)
C(s) + O2(g)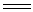 CO2(g) CO2(g)
C(s) + CO2(g)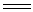 2CO(g) 2CO(g)
将水蒸气通入红热的炭层,就得到CO和H2的混合气体:
C(s) + H2O(g)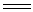 H2(g)
+ CO(g) H2(g)
+ CO(g)

1.
实验室制法:
CO2的实验室制法是用盐酸和大理石(CaCO3)作用:
CaCO3(s) + 2HCl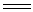 CaCl2 +
H2O + CO2 CaCl2 +
H2O + CO2
2.
工业制备:
在工业上可利用煅烧石灰石生产石灰,以及通过酿造工业而得到大量的CO2副产品:
CaCO3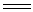 CaO
+ CO2↑ CaO
+ CO2↑
C6H12O6 2C2H5OH + 2CO2↑ 2C2H5OH + 2CO2↑

经典的Na2CO3制备方法是苏尔维(Solvay)制碱法,此法分两步进行,先将CO2通入含NH3的NaCl饱和溶液中,发生如下反应:
NaCl + NH3 + CO2 + H2O 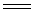 NaHCO3↓+
NH4Cl
NaHCO3↓+
NH4Cl
NaHCO3在水中溶解度较小,析出沉淀。将NaHCO3沉淀煅烧,即可分解制得Na2CO3:
2NaHCO3  Na2CO3
+ CO2 + H2O Na2CO3
+ CO2 + H2O
析出NaHCO3后的母液含NH4Cl,加消石灰可使NH4Cl转化为NH3,以循环使用。此法虽有效利用了NH4Cl,但CaCl2作为副产品用途不大,成为废渣:
2NH4Cl + Ca(OH)2 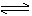 2NH3
+ CaCl2 + 2H2O 2NH3
+ CaCl2 + 2H2O
我国著名的化学工程学家侯德榜对此法作了重大改进,它改进的工艺过程是,在除去NaHCO3沉淀的母液中,加入研细的NaCl固体,利用低温下,NH4Cl比NaCl溶解度小的特点,使NH4Cl从母液中析出,成为副产品,NH4Cl可用于电池工业、染料工业和农肥等,析出NH4Cl后的NaCl溶液则可循环使用,其工艺流程如下图。侯德榜制碱工艺流程的重要贡献在于将制碱和制氨联合起来,故侯氏制碱法也称联合制碱法。另外,此工艺流程做到物尽其用,无“三废”排放,是清洁生产、保护环境的典范。

1.
工业制法:
工业上用焦炭在电炉中将石英砂还原,先得到粗硅:
SiO2 +
2C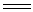 Si + 2CO↑ Si + 2CO↑
然后,将粗硅再转变成SiCl4:
Si + 2Cl2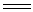 SiCl4 SiCl4
用精馏的方法将SiCl4提纯后,再用纯锌或镁还原SiCl4得到较高纯度的单质硅:
SiCl4 +
2Zn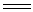 Si + 2ZnCl2 Si + 2ZnCl2
最后用物理方法-区域熔融法来进一步提纯,得到高纯度的硅.

将适量的Na2SiO3溶液与酸混合,调节用量,使生成的凝胶中含8%~10%的SiO2,将凝胶静置24h,使其老化,然后用热水洗去反应生成的盐,将洗净的凝胶在333K~343K烘干,并徐徐升温到573K活化,即得到多孔性硅胶。若将硅酸凝胶用CoCl2溶液浸泡,则干燥活化后可制得变色硅胶。因为无水COCl2为蓝色,水合COCl2·6H2O为红色,所以根据变色硅胶由蓝变红可以判断硅胶的吸水程度。

1.
实验室制备:
硅酸钠可由石英砂SiO2与烧碱或纯碱反应来制备:
SiO2 + 2NaOH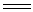 Na2SiO3 +
H2O Na2SiO3 +
H2O
SiO2 +
Na2CO3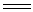 Na2SiO3 +
CO2 Na2SiO3 +
CO2
2. 工业制法:
工业上制备硅酸钠的方法是:将不同比例的Na2CO3和SiO2混合后放在反射炉中锻烧(约1600K).一小时以后,将产物冷却,即得玻璃块状物,它们是组成不同的多种硅酸钠盐,最简单的一种是偏硅酸钠Na2SiO3。煅烧后的产物常因含有铁盐杂质而呈蓝绿色。它溶于水成粘稠溶液,即成商品,俗称“水玻璃”,又名“泡花碱”。其化学组成为Na2O·nSiO2。

将原料水玻璃、铝酸钠、氢氧化钠和水接一定配比混合均匀,在密封的反应容器中加热,在373K左右加热几个小时后冷却,将产物进行洗涤、过滤、烘干,即得到白色的A型分子筛原粉。根据需要,加入粘合剂和适量的水,混合均匀,挤压成条或滚成球形。

由于硅不能直接与H2作用,因此甲硅烷的制备是以SiO2为原料先制得金属硅化物,再与酸反应:
SiO2 + 4Mg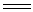 Mg2Si
+ 2MgO Mg2Si
+ 2MgO
Mg2Si + 4HCl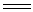 SiH4
+ 2MgCl2 SiH4
+ 2MgCl2
这样制得的SiH4不纯,通常含有乙硅烷、丙硅烷等杂质。用强还原剂氢化铝锂LiAlH4还原硅的卤化物,可制得高纯度的SiH4:
SiCl4 +
LiAlH4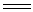 SiH4 + LiCl +
AlCl3 SiH4 + LiCl +
AlCl3
SiH4被大量地用于制高纯Si。硅的纯度越高,大规模集成电路的性能就越好。

1)
由氢氟酸与SiO2或氟化物与SiO2作用制备SiF4:
SiO2 +
4HF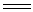 SiF4↑+ 2H2O SiF4↑+ 2H2O
SiO2 +
2CaF2 + 2H2SO4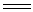 SiF4↑+
2CaSO4↓+ 2H2O SiF4↑+
2CaSO4↓+ 2H2O
2)
由于Si-F键能大,Si与F2在常温下就能生成SiF4:
Si + 2F2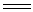 SiF4↑ SiF4↑

SiCl4可由硅直接加热氯化或SiO2与氯一起加热来制备:
Si +
2Cl2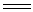 SiCl4 SiCl4
SiO2 + 2C + 2Cl2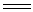 SiCl4
+ 2CO↑ SiCl4
+ 2CO↑

|