|
镧系元素中只有钷是放射元素,仅在铀矿中有痕量存在,其他镧系元素并不稀有。我国的稀土元素不仅储量占世界首位,而且稀土矿物的品位也高,例如,独居石中稀土氧化物的品位为60%,磷钇矿中钇的含量达60%,除含有稀土元素外,还含有Nb,Ta,Ti,Th和U等元素。稀土矿的成分见下表
注:1、表中数据均为稀土氧化物总含量中各成分所占百分比。
最有开采价值和最重要的稀土矿是独居石CePO4·Th3(PO4)4,磷钇矿Y(PO4)和氟碳铈镧矿(Ce,La)FCO3。独居石的主要成分是钍和镧系元素的磷酸盐;也含有少量的铀。磷钇矿的主要成分是钇和镧系元素的磷酸盐;氟碳铈镧矿的主要成分是铈、镧及其他镧系元素的氟碳酸盐。
2LnPO4 + 3H2SO4(浓)
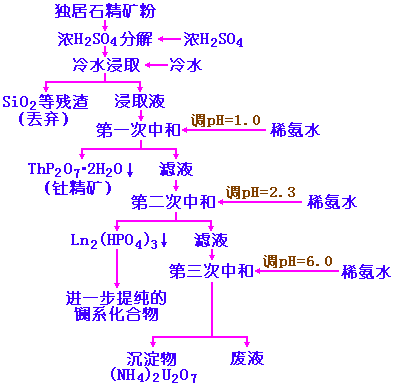
ThSiO4 + 2H2SO4(浓) 反应完毕后,产物为暗灰色的粘性物质,其中含有稀土硫酸盐、钍和铀的硫酸盐、磷酸、未反应完的浓H2SO4和不溶的残渣等。
然后,用大量冷水浸取。使硫酸盐、磷酸等进入溶液,并除去不溶的SiO2等残渣,即可得到稀土、钍和铀硫酸盐的浸取液。
在硫酸盐的浸取液中,加入稀氨水,将溶液中和至pH=l,并加热至沸,此时,钍则呈难溶的焦磷酸盐沉淀析出,分离出钍的磷酸盐。滤液第二次用稀氨水中和至pH=2.3,使大部分镧系元素,以Ln2(HPO4)3形式沉淀,分离出的沉淀可进一步提取纯的镧系化合物;滤液用稀氨水第三次中和至pH=6.0,则生成(NH4)2U2O7沉淀,沉淀可进一步提取铀。
离子交换法是用离子交换树脂在交换柱内分离混合离子的方法。一般包括树脂的吸附和淋洗两个过程。
由于阳离子交换树脂对离子的吸附能力是随离子电荷的增加而增大,随离子半径增大而减小,故镧系离子可不同程度地被吸附。但由于镧系离子Ln3+的电荷相同但离子半径相差很小,被吸附程度差异小,故单纯利用树脂的吸附过程,无法达到使混合镧系离子分离的目的。
Ln3+(树脂上)+(NH4)3HY(溶液)
由于离子半径从Lu3+—La3+递增,所形成的配合物稳定性:LuHY最大,LaHY最小,因此,在淋洗过程中,Lu3+离子首先与配合剂形成配合物而解吸,即Lu3+首先被淋洗出来,而La3+离子最后淋洗出来。若能将淋洗液种类、浓度、酸度、淋洗速度、交换柱高度等控制在最佳条件,则可从淋洗液中依次收集到从Lu3+—La3+单个的很纯的镧系离子溶液。然后,采用加草酸的办法,使之以镧系草酸盐沉淀从溶液中析出,经灼烧即可得到镧系氧化物。
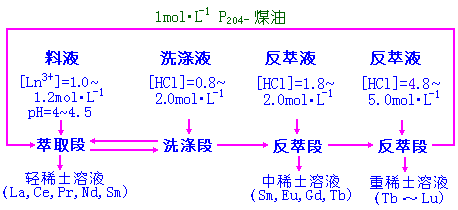
此法是利用镧系盐类在水相和有机溶剂(或萃取剂及稀释剂)中有不同分配比的性质,进行分离。分配比是镧系离子在有机相与水相中的总浓度比,D=C有/C水,分配比越大,说明Ln3+离子越易进入有机相。
在萃取时,分配比大于1的重稀土元素萃取进入有机相,分配比小于1的轻稀土元素留在水相。Ln3+离子的分配比,与体系酸度大小也有关。在实际生产中,根据水相酸度的不同可将镧系分为三组。
将镧系金属与氧直接化合(在423~453K灼烧),或将镧系元素的氢氧化物、草酸盐、碳酸盐、硝酸盐或硫酸盐在空气中灼烧,除铈生成黄白色CeO2、镨生成黑色Pr6O11(相当于Pr2O3·4PrO2)、铽生成暗棕色的Tb4O7(相当于Tb2O3·2TbO2)以外,其余均生成三价氧化物Ln2O3。镨和铽是混合价态的深色氧化物,它们均是非化学计量的化合物。将CeO2,Pr6O11和Tb4O7用H2还原,可得到+3氧化态的氧化物。
Ln3+与氨水或NaOH溶液作用,即可制得氢氧化物Ln(OH)3沉淀。
Ln3+ + 3NaOH
Ln3+ + 3NH3·H2O
LnCl3极易溶于水,在空气中易潮解,在水溶液中微水解。从水溶液中析出的氯化物常为六水结晶。若要制备无水氯化物较麻烦。用一般加热脱水的方法会部分水解,生成难溶于水的碱式盐:
LnCl3·6H2O 一般可用在氯化氢气流中将LnCl3·6H2O加热脱水的方法制备无水氯化物,因氯化氢可抑制水解作用:
更佳的方法是将Ln2O3和NH4Cl固体混合共热,即可制得无水氯化物。
Ln2O3 + 6NH4Cl(s)
Ln(NO3)3易溶于水,由溶液结晶析出的是六水硝酸盐。硝酸盐受热时,先分解为碱式盐,进一步受热则分解为氧化物:
2Ln(NO3)3
4LnONO3 用真空加热脱水干燥法,或在Ln(NO3)3·6H2O中加入浓硝酸等方法,均可得无水硝酸盐。
除硫酸铈、硫酸镧为九水合物外,其余的硫酸盐均为八水合物Ln2(SO4)3·8H2O。水合硫酸盐加热时,随温度的升高一般可发生以下三步反应:
Ln2(SO4)3·8H2O
Ln2(SO4)3
(LnO)2SO4
将草酸晶体(H2C2O4·2H2O)或饱和溶液加至可溶性镧系盐溶液中,可获得镧系草酸盐沉淀,放置后转变成结晶:
2Ln3+ + 3H2C2O4 + nH2O
式中结晶水一般为10,也有别于,7,9或11等。 镧系水合草酸盐,加热至313~533K时,可生成无水草酸盐:
|