|
1.
工业制备:
工业上制备单质硼一般有以下几种方法:
1) 碱法
(a) 用浓碱液分解硼镁矿得到偏硼酸钠:
Mg2B2O5·H2O
+ 2NaOH 2NaBO2 +
2Mg(OH)2 2NaBO2 +
2Mg(OH)2
(b) 将NaBO2从强碱溶液中结晶出来,使之溶于水成为较浓的溶液,通入CO2调节酸度,浓缩结晶即得到四硼酸钠,即硼砂:
4NaBO2 +
CO2 + 10H2O Na2B4O7·10H2O
+ Na2CO3 Na2B4O7·10H2O
+ Na2CO3
(c) 将硼砂溶于水,用硫酸调节酸度,可析出溶解度小的硼酸晶体:
Na2B4O7 +
H2SO4 + 5H2O 4H3BO3
+ Na2SO4 4H3BO3
+ Na2SO4
(d) 加热使硼酸脱水生成B2O3:
2H3BO3 B2O3
+ 3H2O B2O3
+ 3H2O
(e) 用镁或铝还原B2O3得到粗硼:
B2O3
+ 3Mg 2B + 3MgO 2B + 3MgO
2) 酸法
用硫酸分解硼镁矿一步制得硼酸:
Mg2B2O5·H2O
+ 2H2SO4 2H3BO3 +
2MgSO4 2H3BO3 +
2MgSO4
此方法虽简单,但需耐酸设备等条件,故不如碱法好。
粗硼用盐酸、氢氧化钠和氟化氢处理,可得纯度为95%~98%的棕色无定形硼。
3) 碘化硼热解制碘和硼或三溴化硼还原
将碘化硼在灼热(1000K~1300K)的钽丝上热解,可得到纯度达99.95%的a-菱形硼:
2BI3 2B
+ 3I2 2B
+ 3I2
若将三溴化硼或三氯化硼和氢的混合气体通过热的钨丝,则可制得黑色的纯硼:
2BCl3(g)
+ H2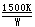 2B(s) + 6HCl(g) 2B(s) + 6HCl(g)
4)
电解熔融的B2O3制纯硼
用电解熔融的B2O3与KBF4混合物的方法也可制得纯硼。

乙硼烷不能通过硼和氢直接化合制得,而要通过间接途径。B2H6的制备方法有如下几种:
1) 质子置换法
2BMn + 6H+ B2H6
+ 2Mn3+ B2H6
+ 2Mn3+
2) 氢化法
2BCl3 +
6H2 B2H6 + 6HCl B2H6 + 6HCl
3) 负氢离子置换法
3LiAlH4 +
4BF3 2B2H6 + 3LiF
+ 3AlF3 2B2H6 + 3LiF
+ 3AlF3
3NaBH4
+ 4BF3 2B2H6
+ 3NaBF4 2B2H6
+ 3NaBF4
3LiAlH4 +
4BCl3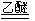 3LiCl + 3AlCl3 +
2B2H6 3LiCl + 3AlCl3 +
2B2H6
第三种方法生成的B2H6的纯度可达90%~95%。由于B2H6是一种在空气中易燃、易爆、易水解的剧毒气体,所以制备时必须保持反应处于无氧、无水状态,原料亦需预先干燥,并且作好安全防护工作。

硼和氢只能通过间接的方法制得一系列的硼氢化合物。与烷烃类似,故统称为硼烷。目前已制得20多种硼烷。可用BnHn+4和BnHn+6通式表示。
乙硼烷的制备方法见上面所述,而其他硼烷可由乙硼烷分解制得:

B2O3一般用加热硼酸使之脱水的方法制备.
2H3BO3 B2O3
+ 3H2O B2O3
+ 3H2O

工业上,硼酸是用硫酸分解硼的矿物来制备:
Mg2B2O5·H2O + H2SO4 2H3BO3
+ 2MgSO4 2H3BO3
+ 2MgSO4
Na2B4O7·10H2O + H2SO4 4H3BO3
+ Na2SO4 + 5H2O 4H3BO3
+ Na2SO4 + 5H2O

工业上用浓碱溶解硼镁矿得到NaBO2,然后通CO2,调pH值,可制得硼砂:
Mg2B2O5·H2O + 2NaOH(浓) 2NaBO2
+ 2Mg(OH)2 2NaBO2
+ 2Mg(OH)2
4NaBO2 + CO2 + 10H2O  Na2B4O5(OH)4·8H2O
+ Na2CO3 Na2B4O5(OH)4·8H2O
+ Na2CO3

1.
工业制备三溴化硼:
在工业生产中三溴化硼可采用元素硼溴化法,生产过程如下所示:
将干燥的元素硼粉装入管式反应炉的反应管中,然后将已在溴釜中加热至微沸的溴也通入反应管中。反应至淡黄色的液体溴化硼生成导入脱溴器中,与锌粉、铝屑、活性炭共同加热回流至无色,再经粗馏、精馏即得完全无色的溴化硼。
2.
三卤化硼的制备:
1) 硼和卤素直接反应可生成三卤化硼:
2B + 3X2 2BX3
(X=F,Cl,Br,I) 2BX3
(X=F,Cl,Br,I)
2) 用氯化法,以B2O3和C为原料,通入Cl2气也可制得BCl3:
B2O3
+ 3C + 3Cl2 2BCl3
+ 3CO 2BCl3
+ 3CO
3) 以萤石,浓H2SO4和B2O3一起加热很容易制得BF3:
B2O3
+ 3CaF2 + 3H2SO4(浓) 2BF3
+ 3CaSO4 + 3H2O 2BF3
+ 3CaSO4 + 3H2O
4) 用B2O3与HF酸作用,也可制得BF3:
B2O3
+ 6HF 2BF3 +
3H2O 2BF3 +
3H2O
5) 用置换法,使BF3与AlCl3或AlBr3反应,可得BCl3或BBr3:
BF3(g) + AlCl3 AlF3
+ BCl3 AlF3
+ BCl3
BF3(g)
+ AlBr3 AlF3
+ BBr3 AlF3
+ BBr3

1.
工业制法:
工业上冶炼铝的步骤如下:
1) 用NaOH溶液处理铝矾土矿或用碳酸钠焙烧铝矾土矿得到铝酸盐NaAl(OH)4:
|
Al2O3 + 2NaOH + 3H2O 2NaAl(OH)4 2NaAl(OH)4
Al2O3
+ Na2CO3 2NaAlO2
+ CO2 2NaAlO2
+ CO2
|
2) 将铝酸盐溶液静置澄清除去不溶杂质后,在滤液中通入CO2使铝酸盐水解析出Al(OH)3:
|
NaAl(OH)4 + CO2 Al(OH)3
+ NaHCO3 Al(OH)3
+ NaHCO3
2NaAlO2 + CO2 + 3H2O 2Al(OH)3
+ Na2CO3 2Al(OH)3
+ Na2CO3
|
3)
将Al(OH)3沉淀过滤、洗涤、干燥、再煅烧,便得到符合电解需要的纯净Al2O3.
2Al(OH)3 Al2O3
+ 3H2O Al2O3
+ 3H2O
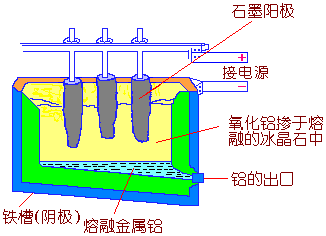
4) 将Al2O3熔在熔融的冰晶石Na3AlF6(作为电解介质)中进行电解,可制得Al。
电解约在1300K时进行,在阴极上得到金属铝,铝是液态的,可以定时放出,铸成铝锭。
|
|
|
图15-1
铝电解槽的结构示意图
|
电解槽为铁的外壳,里面是用耐火砖砌成的绝热层和碳衬里(兼做阴极),用大块的石墨作阳极(图15-1所示)。电解时在阳极产生的O2使石墨电极燃烧而消耗,故需要把它逐渐下降。阳极产物除O2、CO、CO2外,同时还生成少量的F2和CF4。电解熔体的表面被电解质的硬壳所覆盖,起保温作用,但在周期地加入Al2O3和少量的冰晶石时必须敲开硬壳。电解时电压为5V,电流强度为60000A,每电解出1t金属铝要消耗约2×104kwh的电能。电解铝的纯度一般为98%~99%,杂质主要有Si、Fe和微量的Ga。
金属铝制备的工艺流程如下图:

1.
α-Al2O3的制备:
由金属铝在氧中燃烧或高温灼烧Al(OH)3,Al2(SO4)3等所得到的氧化铝为α-Al2O3:
2Al + 3O2  Al2O3
Al2O3
2Al(OH)3 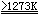 Al2O3
+ 3H2O Al2O3
+ 3H2O
2.
γ-Al2O3的制备:
在723K左右加热Al(OH)3或铝盐如(NH4)2SO4·Al2(SO4)3·24H2O所得到的氧化铝为γ-Al2O3:
2Al(OH)3 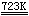 Al2O3
+ 3H2O Al2O3
+ 3H2O

在铝酸盐溶液中通入CO2可得到白色的氢氧化铝Al(OH)3沉淀:
2NaAlO2 + CO2 + 3H2O  2Al(OH)3 + Na2CO3
2Al(OH)3 + Na2CO3

用Al2O3与碱熔融可制得铝酸盐:
Al2O3 + 2NaOH  2NaAlO2 + H2O
2NaAlO2 + H2O

1.
工业制法:
1)
由熔融的Al和Cl2直接加热而制取无水AlCl3:
2Al + 3Cl2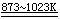 2AlCl3 2AlCl3
|
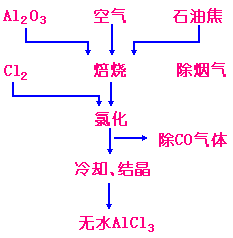
2) 在氧化铝和碳的混合物中通入氯气也可制得无水AlCl3:
Al2O3 + 3C + 3Cl2 2AlCl3
+ 3CO↑ 2AlCl3
+ 3CO↑
该方法的工艺过程见右图所示:先将Al2O3和石油焦混合,在1073K下通入空气焙烧,除去烟气,在1223K下再和Cl2反应.生成物经冷却、结晶得无水AlCl3。 |
|

在工业上用硫酸处理铝土矿或粘土都可得到纯度不高的Al2(SO4)3.
Al2O3 +
3H2SO4  Al2(SO4)3 + 3H2O
Al2(SO4)3 + 3H2O
H2Al2(SiO4)2·H2O(粘土)
+ 3H2SO4  Al2(SO4)3 + 2H4SiO4
+ H2O
Al2(SO4)3 + 2H4SiO4
+ H2O
而使用Al(OH)3与硫酸反应可得纯的Al2(SO4)3
2Al(OH)3 + 3H2SO4  Al2(SO4)3 + 6H2O
Al2(SO4)3 + 6H2O

因为镓常与铝、锌、锗等金属混在一起,所以可在提取出铝、锌、锗之后的废料中提取镓。
例如,在从铝矾土矿中制备Al2O3的工艺流程中,铝酸盐溶液经C02酸化后分离出Al(OH)3沉淀的母液中富集了镓。将母液再次经CO2酸化后便可得到富集了Ga(OH)3的Al(OH)3沉淀,将沉淀分离,使之溶于碱中,进行电解:
Ga(OH)3 +
OH- Ga(OH)4- Ga(OH)4-
Ga(OH)4-
+ 3e- Ga +
4OH-(阴极) Ga +
4OH-(阴极)
因铝不干扰镓的电解,故可得液态的金属镓。
再如,煤燃烧后集得的烟道灰富集有镓和锗。将烟道灰氯化,可得GeCl4和GaCl3,蒸馏出GeCl4后,在盐酸介质中用磷酸三丁酯(TBP)苹取,分离Fe、Mo、V等杂质后,在碱性介质中电解镓酸钠溶液也可得到金属镓。
将电解所得的粗镓经酸碱处理或制成三氯化镓进行区域熔融,再电解其碱溶液,可将镓提纯至99.999%以上。镓的很多宝贵的特性都与纯度有关。

将提取过锌的闪锌矿残渣用硫酸浸取,酸浸取液经中和后投人锌片,铟就沉积在锌片上,用极稀的硫酸溶去锌,将不溶杂质溶于硝酸,再加入BaCO3便沉淀出氧化铟,在高温下用氢还原为金属铟。
工业铟的纯度一般为99.5%,主要杂质有锡、镉、锌、铋和铊,经过化学处理、电解、真空蒸馏.可提纯至99.9999%。

铊主要是从硫化物矿焙烧的烟道灰中提取的,可用热水或稀硫酸浸取,再制成氯化亚铊或还原为金属。
粗铊常含有铅、锌、镍等杂质,用热的稀硫酸溶解铊,稍加稀释除去硫酸铅,再用盐酸和热的稀硫酸反复沉淀和溶解,将铊进一步提纯,最后电解为金属。
 |