|
铍属于活泼金属,它的制备方法有:
(1)电解无水熔融的铍盐,如氯化铍。
BeCl2(熔融态)  Be + Cl2
Be + Cl2
(2)用金属镁还原氟化铍BeF2。
Mg + BeF2  Be + MgF2 Be + MgF2

用金属铍在氧气中燃烧,或铍的碳酸盐,硝酸盐,氢氧化物加热分解,即可得到白色粉末状的BeO.
2Be + O2  2BeO
2BeO
BeCO3  BeO
+ CO2
BeO
+ CO2
Be(OH)2
 BeO
+ H2O BeO
+ H2O

1)
热还原法:
用白云石CaMg(CO3)2加热分解得到氧化钙和氧化镁的混合物,在镍容器中以铁硅还原,最后镁在真空中蒸馏出来。
2MgO(s) + 2CaO(s)
+ Si(s)  2Mg(g) + Ca2SiO4(s) 2Mg(g) + Ca2SiO4(s)
工业上也可用碳或CaC2作还原剂,在2000℃时还原氧化镁制得镁:
|
MgO(s) + C(s) 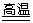 Mg(s)
+ CO(g)
Mg(s)
+ CO(g)
|
|
MgO + CaC2 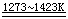 CaO
+ Mg + 2C
CaO
+ Mg + 2C
|
2)
熔融电解法:
电解熔融的无水氯化镁,适用于从海水中提取镁:
MgCl2  Mg
+ Cl2↑
Mg
+ Cl2↑

1)
金属镁在高温下燃烧:
2Mg + O2  2MgO
2MgO
2) 工业上一般通过煅烧碳酸镁或氢氧化镁来生产氧化镁:
MgCO3  MgO
+ CO2↑
MgO
+ CO2↑
Mg(OH)2  MgO
+ H2O
MgO
+ H2O
煅烧温度在923K左右制成的为轻质MgO,煅烧温度在1923K以上时制成的为重质MgO.

将海水和廉价的石灰乳反应,即可得到Mg(OH)2沉淀.
Mg2+ + Ca(OH)2
 Mg(OH)2
+ Ca2+ Mg(OH)2
+ Ca2+

用六水合氯化镁在干燥的氯化氢气流中加热脱水而得.
|
MgCl2·6H2O |
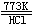
|
MgCl2 + 6H2O↑
|

Mg(OH)2 + C O2
+ 2H2O  MgCO3·3H2O MgCO3·3H2O
5MgCO3·3H2O  4MgCO3·Mg(OH)2·4H2O
+ 10H2O + CO2 4MgCO3·Mg(OH)2·4H2O
+ 10H2O + CO2

金属钙的制备方法有:
1) 电解熔融氯化钙:
|
CaCl2 |

|
Ca + Cl2
|
2)
用金属铝在真空和1473K温度下还原石灰:
|
3CaO + 2Al |

|
3Ca + Al2O3
|
还原法成本低,目前正在代替电解法而成为制钙的主要方法。

在工业上是由煅烧石灰石制得.
CaCO3
 CaO
+ CO2↑ CaO
+ CO2↑

将生石膏加热到625K以上,即可得到无水硫酸钙.
CaSO4·2H2O
 CaSO4
+ 2H2O CaSO4
+ 2H2O

用CaCl2与Na3PO4作用而制得。
3CaCl2 +
2Na3PO4  Ca3(PO4)2↓
+ 6NaCl Ca3(PO4)2↓
+ 6NaCl

用硫酸处理Ca3(PO4)2·H2O矿粉,可制得过磷酸钙。它是一种常用的水溶性磷肥,主要成分是Ca(H2PO4)2和无水CaSO4:
Ca3(PO4)2
+ 2H2SO4  2CaSO4
+ Ca(H2PO4)2
2CaSO4
+ Ca(H2PO4)2

电石是由生石灰与焦碳(或无烟煤)混合,在电炉中煅烧制得:
2CaO + 4C  2CaC2
+ O2↑
2CaC2
+ O2↑

1)
电解熔融的SrCl2和KCl的混合物;
SrCl2  Sr
+ Cl2
Sr
+ Cl2
2) 真空下用Al还原SrO
2Al + 3SrO  Al2O3
+ 3Sr
Al2O3
+ 3Sr

1)
金属锶在室温或加热下,能与氧气直接化合生成SrO:
2Sr+O2 2SrO 2SrO
2) 碳酸锶或硝酸锶加热分解也可制得SrO:
2Sr(NO3)2 2SrO
+ 4NO2 + O2 2SrO
+ 4NO2 + O2
SrCO3 SrO
+ CO2 SrO
+ CO2

将碳酸锶与硝酸作用并在20℃时结晶,即得Sr(NO3)2·2H2O.
SrCO3 +
2HNO3 + H2O  Sr(NO3)2·2H2O + CO2
Sr(NO3)2·2H2O + CO2

1)
电解熔融的氯化钡。
BaCl2  Ba
+ Cl2
Ba
+ Cl2
2) 在真空中,用Al或Si在1473K还原BaO或BaCl2:
3BaO + 2Al  Al2O3
+ 3Ba
Al2O3
+ 3Ba
3BaO + Si  BaSiO3
+ 2Ba
BaSiO3
+ 2Ba
3) 钡的氮化物热分解:
Ba3N2
 N2
+ 3Ba N2
+ 3Ba

BaO2的制备方法除氧化钡在773K~793K时与氧气作用直接生成外,还有间接方法制备BaO2,即室温下以氨水为介质,使Ba(NO3)2和H2O2作用:
2BaO + O2  2BaO2
2BaO2
Ba(NO3)2
+ 3H2O2 + 2NH3·H2O  BaO2·2H2O2
+ 2NH4NO3 + 2H2O
BaO2·2H2O2
+ 2NH4NO3 + 2H2O
然后加热到383K~388K,即脱去H2O2而得BaO2。BaO2可用作供氧剂、引火剂等。

工业上用下面的方法制取Ba(NO3)2:
(1) 2NaNO3 + BaCl2
 Ba(NO3)2
+ 2NaCl Ba(NO3)2
+ 2NaCl
(2) 2NaNO3 + BaS  Ba(NO3)2
+ Na2S
Ba(NO3)2
+ Na2S

工业上是在高温下用煤气使重晶石BaSO4还原为BaS,再使BaS与CaCl2反应而生成BaCl2:
BaSO4 +
4C  BaS
+ 4CO BaS
+ 4CO
BaS + CaCl2  BaCl2
+ CaS
BaCl2
+ CaS
在BaCl2溶液中加入NaOH,经浓缩、结晶可制取Ba(OH)2。

工业上,常用煤粉还原重晶石法制备BaS,其工艺过程为:先将重晶石预处理,除去硅、铁、铝等杂质,然后,将重晶石和煤按比例混合,经粉碎、筛分后放入转炉,在1273~1573K下进行还原反应。
BaSO4 + 4C  BaS
+ 4CO BaS
+ 4CO
BaSO4 + 4CO  BaS
+ 4CO2 BaS
+ 4CO2
得到粗BaS后,在经热水洗涤,弃去残渣,母液经蒸发、浓缩、结晶,可得到纯净的BaS·6H2O,工业上也可直接用澄清的BaS水溶液供制备其他钡盐使用。BaS生产的工艺流程如图:

BaCO3可用下述方法制取。用粉状重晶石与煤粉混合,控制温度在1173K~1473K,在转炉中进行还原焙烧,发生下述反应:
BaSO4 + 4C
 BaS
+ 4CO BaS
+ 4CO
BaSO4 +
4CO  BaS
+ 4CO2 BaS
+ 4CO2
用水浸取焙烧产物,由于BaS水解:
2BaS + 2H2O Ba(HS)2
+ Ba(OH)2 Ba(HS)2
+ Ba(OH)2
产生可溶于H2O的Ba(HS)2和Ba(OH)2。在上述溶液中,通入CO2酸化溶液,即生成BaCO3沉淀:
Ba(HS)2
+ CO2 + H2O BaCO3 +
2H2S BaCO3 +
2H2S
BaCO3溶于盐酸得到可溶性钡盐BaCl2。

|