|
铜矿中一般铜含量为2%~10%(贫矿<0.6%,富矿可达20%),其主要杂质为SiO2,Al2O3,CaO,MgO等。随矿石的性质不同常用不同的冶炼方法。 a.
赤铜矿的冶炼: b. 黄铜矿的冶炼:
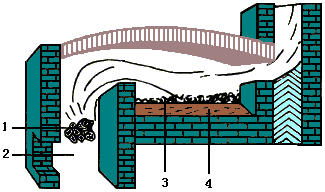
铜的硫化物矿黄铜矿(CuFeS2)常用“冰铜熔炼法”,此法处理过程较复杂,有以下几个基本过程。 2) 氧化焙烧:将富矿送沸腾炉中,通空气在923~1073K进行焙烧,使矿中的部分杂质硫和FeS被空气中O2氧化为SO2(被除去)和FeO。主要反应如下:
2CuFeS2 + O2
2FeS + 3O2 此时,主要成分为Cu2S和FeS,称为焙砂,二者质量比约为1:1。焙砂中仍含有一定量FeO,SiO2,CaO等杂质。 3) 熔炼:将焙砂送入反射炉进行高温(1773~1823K)熔炼,高温下CuS和FeS结成熔体,即为铜含量达18%~20%的冰铜(Cu2S·FeS)。使铜进一步富集,同时碱性氧化物FeO和CaO与酸性氧化物SiO2等杂质便结成炉渣而除去。主要方程式为:
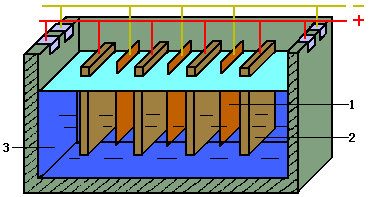
吹炼所得粗铜含有0.3%~0.5%的杂质(Ni,Fe,Pb,Sb,Bi,Ag,Au等),粗铜导电性不高。为获得高导电性更纯的铜须用电解精炼。
阳极反应:Cu(粗) - 2e
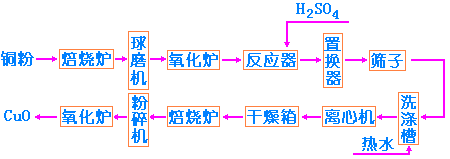
1. 工业制法: 目前工业上采用铜粉氧化法制备CuO。将铜灰加入焙烧炉,加热氧化,除去铜灰中水分和有机杂质。经冷却、粉碎后在氧化炉中进行二次氧化,得到粗制的CuO。
2Cu + O2
Cu2O + 1/2O2 将粗品CuO及1:1的H2SO4加入反应器,加热,且不断搅拌,反应至液体的密度增加一倍,pH达2~3时反应完成,得到CuSO4液体。放置澄清,清液输入置换器,加入铁刨花,在加热及搅拌下置换出铜粉,反应如下:
CuSO4 + Fe
将Cu粉过60目筛,且用热水洗涤至无SO42-和铁质。经离心分离、干燥,得到纯Cu粉,纯Cu粉置焙烧炉内,在723K下焙烧8h。冷却后粉碎至100目,在氧化炉中再氧化,可得精制CuO成品。
2. 实验室制备: 实验室常用加热铜的含氧酸盐或煅烧天然孔雀石(碱式碳酸铜)的方法制得氧化铜:
Cu2(OH)2CO3
2Cu(NO3)2
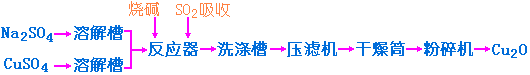
1. 工业制法: 工业上生产氧化亚铜的方法有干法、湿法和电解法。下面主要介绍湿法。该法用CuSO4为原料,Na2SO3为还原剂,以烧碱调整酸度而制得。先将98%CuSO4和96%Na2SO3分别在溶解槽中加热溶解,且分别过滤除去机械杂质。然后把这两溶液输入反应器,温度保持在80~85℃,反应开始时,用烧碱调节反应溶液呈酸性(pH=5),在100~104℃下进行。
2CuSO4 + 3Na2SO3
随着反应不断进行,由于SO2的生成,使溶液pH值下降,为此,需继续添加烧碱,保持溶液的pH=5,并随时添加水维持液面。沸腾2h,直至沉淀物呈紫红色且易沉降,表面光滑,SO2气体逸出量减少时可停止加热。
2. 实验室制备: 氧化亚铜的实验室制法是用碱性铜酸盐(如Na2Cu(OH)4)溶液用葡萄糖还原,可制得Cu2O。
2Cu(OH)42- + C6H12O6
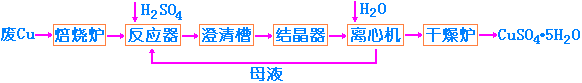
1. 工业制法:
CuSO4·5H2O俗称胆矾,工业上用硫酸法和电解法等多种方法制备。现以硫酸法为例简述如下。
2. 实验室制备: 实验室可通过CuO和硫酸反应,或Cu和热的浓硫酸,或在用氧存在时用铜屑和稀硫酸反应都可制得:
2Cu + O2 + 2H2SO4(稀)
CuO + H2SO4
CuF(易歧化,未曾制得纯态)呈红色,CuCl为白色,CuBr和CuI为白色或淡黄色。CuCl,CuBr和CuI均难溶于水。除CuF外,均可用Cu2+离子溶液与还原剂(如Cu,SnCl2,SO2等)在相应卤素存在的条件下反应制得。
除CuI2至今还未制得外,其他卤化铜均可用CuO(或CuCO3)和氢卤酸反应制得,也可用Cu直接与卤素反应制备。
CuO + HX
Cu + X2
硫化亚铜是难溶的黑色固体(Ksp=2.26×10-48)。它可由过量铜和硫加热制得,在硫酸铜溶液中,加入硫代硫酸钠溶液,加热,也能得到Cu2S沉淀。
2Cu + S
2Cu2+ + 2S2O32- + 2H2O
|
|||||||||||||||||||||||||