|
1.
实验室制法:
高纯度的氢气是用电解法制备的,用电解水的方法制氢气,常用的是电解稀H2SO4溶液或稀NaOH溶液,但此法生产的氢气过于昂贵。在电解饱和NaCl水溶液制备NaOH的工业生产中,H2是副产品。 2. 工业制备: (a) 用碳来还原水蒸气制取氧气,即:
水煤气可以用做工业燃料,此时H2与CO不必分离,为了制备H2,必须分离CO。具体分离方法是:
CO + H2 + H2O
用煤来制取氢的方法,成本过于昂贵。
其他烃类,如石脑油和柴油也可以用作制氢原料。
(d)
在石油化学工业中,由烷烃制取烯烃反应的副产物即氢气。可直接用于合成氨或石油的精细加工等生产中。
由金属锂直接与氢气反应可制得LiH:
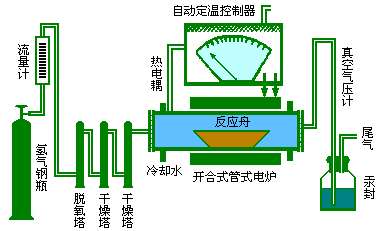
2Li + H2 其制备装置示意图如下所示:
由氢气钢瓶供应氢气,控制以常压放出氢气。氢气经干燥脱氧后进入氢化反应釜,然后通过汞大气封排出体系之外。事先在氢化釜内的反应舟里装入金属锂,在仪器尾部氢气排出口处检查排出的氢气是否纯净;若已经纯净,则开动管式电炉逐步给氢化釜加热,用自动定温控制器检控温度。待氢化反应釜温度升到700℃左右时,熔化的金属锂大量吸氢,反应达到高潮,釜内大量消耗氢,产生部分真空。此时如果有空气由尾部吸入到氢化釜内,就会与氢气组成爆鸣气,产生爆炸。所以本反应的关键是在反应剧烈进行、大量吸氢而产生部分真空时,不让空气吸入到反应体系内,而且最好是自动控制的(图11-1)。
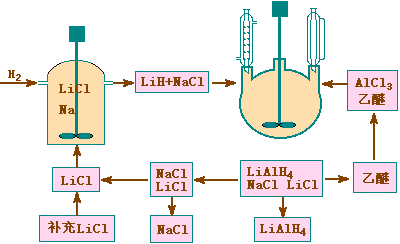
氢化铝锂LiAlH4是火箭的高能燃料之一,是有机反应中的重要的还原剂。氢化铝锂的合成方法一直沿用1947年发现的施莱兴格(Schlessinger M.,美国)法:首先令金属锂与氢气在700℃直接化合生成LiH,然后令氧化锂同无水三氯化铝在乙醚中反应:
2LiCl + 2Na + H2
首先利用金属还原氢化的方法,用LiCl代替金属锂,与金属钠和氢气在400℃直接进行还原氢化反应,得到LiH和NaCl的混合物。
4(LiH+NaCl)
+ AlCl3
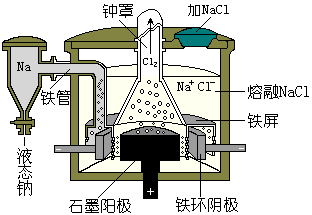
工业上大量制取金属钠的方法是电解熔融氯化钠:
阴极反应: 2Na+ + 2e
阳极反应: 2Cl-
电解反应:
2NaCl 电解时,在NaCl的熔盐中常加入一些氯化钙,一方面可降低熔盐的熔点(NaCl的熔点为1081K,混合盐的熔点是853K),以防止金属钠的挥发(Na的沸点是1153K),同时也增加了熔盐的密度(熔盐的密度大于金属钠的密度),使电解析出的钠浮于熔盐上易于分离,减小金属钠的分散性。此法制得的金属钠中含有少量的钙(约1%)。
用类似方法也可制得镁、锂、钙、锶、钡等单质。
实验室中常用Na还原Na2O2以制得Na2O:
金属钠在高温下与氢气直接反应可得NaH,但反应不完全,产率低。
2Na + H2
工业上,用金属钠氧化法制取过氧化钠,将金属钠加热熔化(393~433K),在573~623K下,通入除去CO2的干燥空气,即可制得Na2O2:
4Na + O2
2Na2O + O2
1. 工业制法: 工业上是用电解食盐水溶液的方法来制备NaOH.
2NaCl(浓) + 2H2O 2. 实验室制法: 用消石灰与碳酸钠浓溶液反应可制得NaOH
Ca(OH)2 + Na2CO3
1.
工业制备:
用电解法制备钾较困难,这是由于钾的沸点较钠低,具有挥发性,此外,金属钾易溶解在熔融混合盐中,使分离较为困难。通常是在高温条件(约1123K)下,用金属钠从液态KCl中置换出钾:
2KF
+ CaC2
可用K还原KNO3制得K2O:
钾(或铷、铯)在过量的氧气中燃烧,可制得相应的超氧化物。
用氢氧化钾与臭氧作用可制得臭氧化钾。
铷和铯的制备一般不用电解熔盐法,而通常用化学还原法。在高温高压下,以金属钠做还原剂,还原铷和铯的氯化物可制得它们的单质:
Na(g) + MCl(g) 由于Rb,Cs,都较Na更易挥发,因而,在反应过程中,控制适当的温度即可得到纯度较高的单质。 |