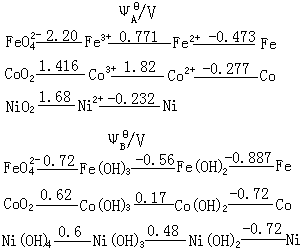|
一:第Ⅷ族元素的分组 第Ⅷ族元素在周期系中是特殊的一族,它包括4、5、6三个周期的九种元素:铁、钴、镍、钌、铑、钯、锇、铱、铂。 Ⅷ族在周期系中位置的特殊性是与它们之间性质的类似和递变关系相联系的。在九种元素中,虽然也存在通常的垂直相似性,如Fe、Ru和Os,但是水平相似性如Fe、Co和Ni则更为突出些。因此,为了便于研究,通常又把这九种元素分成两组,称Fe、Co、Ni三种元素为铁系元素,并在一起叙述和比较,其余六种元素则称为铂系元素。 二:
铁系元素的基本性质
由表可见,它们的原子半径、离子半径、电离势等性质基本上随原子序数增加而有规则的变化。镍的原子量比钴小,这是因为镍的同位素中质量数小的一种占的比例大。 三:铁系元素的通性 铁、钴、镍三种元素的最外层都有两个电子,次外层d电子分别为6、7、8而且原子半径也很相近,所以它们的性质很相似。一般条件下,铁表现+Ⅱ和+Ⅲ氧化态,在强氧化剂存在条件下,铁可以出现不稳定的+Ⅵ氧化态(高铁酸盐)。钴在通常条件下表现为+Ⅱ,在强氧化剂存在时能出现不稳定的+Ⅲ氧化态;镍则经常表现为+Ⅱ氧化态。这反映出第一过渡系元素发展到Ⅷ族时,由于3d轨道已超过半充满状态,全部价电子参加成键的趋势大大降低,除d电子最少的铁可以出现不稳定的较高氧化态外,d电子较多的钴和镍都不显高氧化态。 四: 铁系元素的标准电势图 铁系元素的标准电势图如下。
一: 物理性质 铁、钴、镍单质都是具有白色光泽的金属。铁、钴略带灰色,而镍为银白色。它们的密度都较大,熔点也较高。钴比较硬而脆,铁和镍却有很好的延展性。此外,它们都表现有铁磁性,所以钴、镍、铁合金是很的磁性材料。SmCo5永磁性大于其它磁性材料十倍以上,用在高磁性要求或超小型的设备和仪表等方面。 二:
化学性质 常温时,铁与浓H2SO4和浓HNO3都产生“钝化"现象而不起作用。但稀的HNO3却能溶解铁,铁也能被浓碱溶液所侵蚀。铁在潮湿空气中会生锈。
铁系元素的氧化物的性质可归纳如下:
铁系元素氢氧化物的性质归纳在下表中.
一:氧化态为+Ⅱ的盐
氧化态为+Ⅱ的铁、钴、镍的盐,在性质上有许多相似之处。它们与强酸形成的盐,如硝酸盐、硫酸盐、氯化物和高氯酸盐等都易溶于水,并且在水中有微弱的水解使溶液显酸性。它们的碳酸盐、磷酸盐、硫化物等弱酸盐都难溶于水。
铁、钴、镍的硫酸盐都能与碱金属或铵的硫酸盐形成复盐。如硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O,俗称摩尔盐。 在酸性溶液中,Fe2+、Co2+、Ni2+分别是铁、钴、镍离子的最稳定状态。空气中的氧可把Fe2+氧化成Fe3+,但不能氧化Co2+和Ni2+成Co3+和Ni3+,说明Fe2+有较强还原性,而Co2+、Ni2+的还原性很弱。 在碱性溶液中,它们+Ⅱ氧化态的还原性均增强。Fe(OH)2被空气中的氧迅速氧化,Co(OH)2缓慢被氧化,而Ni(OH)2不被氧化。 二:氧化态为+Ⅲ的盐 铁、钴、镍中只有铁和钴才有氧化态为+Ⅲ的盐,其中铁盐较多。钴(Ⅲ)盐只能存在于固态,溶于水迅速分解为钴(Ⅱ)盐。类似的镍盐尚未见到,可见镍(Ⅲ)的氧化性更强。 综上所述,对铁系元素的盐的氧化还原性总结如下: 稳定性减弱,还原性增强 ←------------------ Fe(Ⅱ) Co(Ⅱ) Ni(Ⅱ) Fe(Ⅲ) Co(Ⅲ) Ni(Ⅲ) ------------------→ 稳定性减弱,氧化性增强
一:氨配合物 Fe2+和 Fe3+遇氨水是不能获得它们的氨配合物, 而是得到相应的Fe(OH)2[立即被空气中的氧氧化成Fe(OH)3]和Fe(OH)3沉淀。 Co2+与过量氨水先生成可溶性的氨合配离子[Co(NH3)6]2+。不过[Co(NH3)6]2+不稳定,可被空气中的氧氧化成[Co(NH3)6]3+。 Ni2+与过量NH3能形成稳定的蓝色[Ni(NH3)6]2+配离子。 二:硫氰配合物 在Fe3+离子的溶液中,加入硫氰化钾或硫氰化铵,溶液生成血红色的[Fe(SCN)n](3-n)配离子。Fe2+与SCN-形成的配合物不稳定。 Co2+离子与KSCN生成蓝色的[Co(SCN)4]2-配离子,它在水溶液不稳定, 但在丙酮或戊醇溶剂中可稳定存在。 Ni2+离子与KSCN不能形成稳定的配合物。 三:氰配合物 Fe2+离子与过量KCN可形成黄色的稳定配离子[Fe(CN)6]4-。Fe3+离子虽不能直接与过量KCN形成[Fe(CN)6]3-配离子,但用[Fe(CN)6]4-的溶液与氧化剂(如Cl2)反应,可得到Fe3+与CN-结合的深红色的稳定配离子[Fe(CN)6]3-。
Ni2+离子与过量CN-形成稳定的[Ni(CN)4]2-配离子。 第一过渡系中从钒到镍,第二过渡系中的钼到铑,第三过渡系中的钨到铱等元素都能和一氧化碳形成羰基配合物。
在这些配合物中,金属的氧化态为零。而且简单的羰基配合物的结构有一个普遍的特点:每个金属原子的价电子数和它周围CO提供的电子数(每个CO提供两个电子)加在一起满足18电子结构规则,是反磁性的。例如Fe(CO)5,Ni(CO)4,Cr(CO)6,Mo(CO)6等。
除上述单核羰基配合物外,过渡金属还可形成双核以及多核的羰基配合物,如Mn2(CO)10,Co2(CO)8,Fe2(CO)9,Fe3(CO)12等。 除Fe(CO)5、Ni(CO)4、Ru(CO)5和Os(CO)5在常温是液体外,许多羰基配合物在常温下都是固体。这些配合物的熔点和沸点一般都较常见的相应金属化合物低,容易挥发,受热易分解,并且易溶于非极性溶剂。利用这一性质,可以制备纯度很高的金属。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||