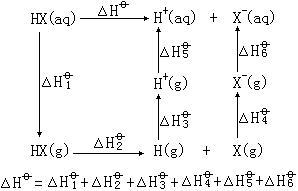|
一:卤族元素的基本性质
第ⅦA族包括氟、氯、溴、碘和砹五种元素,总称为卤素。砹为放射性元素。有关卤族元素的基本性质汇列于下表中。
| 性
质 |
氟(F) |
氯(Cl) |
溴(Br) |
碘(I) |
| 原 子 序 数 |
9 |
17 |
35 |
53 |
| 原 子
量 |
19.00 |
35.45 |
79.90 |
126.90 |
| 价电子构型 |
2s22p5 |
3s23p5 |
4s24p5 |
5s25p5 |
| 主要氧化态 |
-1,0 |
-1,0,+1,
+3,+5,+7 |
-1,0,+1,
+3,+5,+7 |
-1,0,+1,
+3,+5,+7 |
| 共价半径(pm) |
64 |
99 |
114.2 |
133.3 |
| 离子半径(pm) |
133 |
181 |
196 |
220 |
| 第一电离势(kJ/mol) |
1681 |
1251 |
1140 |
1008 |
| 电子亲合势(kJ/mol) |
-322 |
-348.7 |
-324.5 |
-295 |
| 电 负
性 |
3.98 |
3.16 |
2.96 |
2.66 |
| X-离子水合能(kJ/mol) |
-485 |
-350 |
-320 |
-280 |
二:卤素元素的通性
1.
与同周期其它元素比较
卤素原子的价电子层结构是ns2np5,只需获得一个电子即可形成8电子稳定构型的X-离子,因此与同周期其它元素相比,卤素有最大的电子亲合势,最大的第一电离势(稀有气体除外),最大的电负性和最小的原子半径,因此卤素是最活泼的非金属元素。它们的单质都是双原子分子,都具有氧化性。 2.
同族性质比较
卤素在性质上十分相似,但随着原子半径或离子半径的增加,外层电子离核越来越远,尽管核电荷数也相应增加,其影响不如半径增加的影响大,结果使核对价电子的引力逐渐减小,致使卤素性质在相似性中又出现了差异性。如卤素的电离势、电负性和卤离子(X-)的水合焓等从上到下逐渐减小。
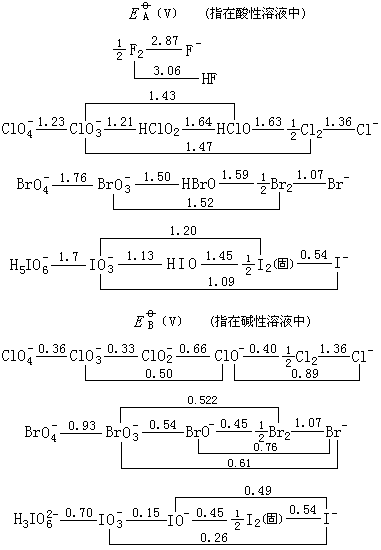
虽然卤素的性质具有差异性,但氟与其它卤素间的差异尤为显著。这是因为氟原子的半径很小造成的。氟元素的特殊性见氟的性质部分。 三:卤素元素电势图
卤素元素标准电极电势值如下所示。

一:物理性质
卤素单质的一些物理性质列于下表中。
| 性
质 |
氟 |
氯 |
溴 |
碘 |
通常
条件 |
聚集状态 |
气 |
气 |
气 |
气 |
| 颜
色 |
淡 黄 |
黄 绿 |
红 棕 |
紫 黑 |
| 毒
性 |
剧 毒 |
毒性大 |
毒 |
毒性较小 |
| 熔
点(K) |
53.38 |
172.02 |
265.92 |
386.5 |
| 沸
点(K) |
84.86 |
238.95 |
331.76 |
457.35 |
| 密
度(g/cm3) |
1.11(l) |
1.57(l) |
3.12(l) |
4.93(s) |
| 溶解度(g/100g水,293K) |
分解水
(放出O2) |
0.732
(有反应) |
3.58 |
0.029 |
| 离解能(kJ/mol) |
154.8 |
239.7 |
190.16 |
148.95 |
标准电极电势Eθ(V)
X2+2e=2X- |
2.87 |
1.36 |
1.07 |
0.54 |
卤素单质由双原子分子组成。这些分子是非极性分子,分子间的结合力为色散力。随着分子量的增大,分子的变形性逐渐增大,分子间的色散力也逐渐增强,因此,卤素单质的熔沸点,密度等物理性质按F-Cl-Br-I的顺序依次递增。
气态卤素单质的颜色随着分子量的增大由浅黄色-黄绿色-红棕色到紫色。物质的颜色通常是由于物质吸收了可见光中某一波长的光(例如绿光)而显示该吸收波长光的互补色(即紫红色)颜色。在卤素元素中,从氟到碘外层电子从基态被激发到较高能级所需的能量逐渐减少,故对可见光的吸收逐渐向波长较长(即能量较低)的部分移动。氟吸收能量大,波长短的紫光而显黄色,而碘吸收能量小,波长长的黄光而显紫色。氯、溴分子吸收能量介于氟、碘之间,它们显现的颜色也在二者之间。
卤素单质分子是非极性分子,因此在极性溶剂中(如水中)溶解度不大。除氟与水相遇猛烈反应外,氯和溴溶于水得氯水和溴水,碘在水中溶解度极小,但易溶于碘化物溶液(如碘化钾)中。
氯、溴、碘在有机溶剂如乙醇、四氯化碳、乙醚、苯、氯仿、二硫化碳等中的溶解度比在水中的溶解度大得多,并呈现一定的颜色。
卤素单质均有刺激气味,强烈刺激眼、鼻、喉、气管的粘膜。它们的蒸气均有毒,吸入较多时,会引起死亡。毒性从氟到碘依次减小,因此使用时要特别小心,注意防护。
二:化学性质
(1)与金属,非金属反应
氟能与所有金属和非金属(除氮、氧和一些希有气体外)包括氢直接化合,而且反应常常是很猛烈的,伴随着燃烧和爆炸。
氯也能与各种金属和大多数非金属(除氮、氧、希有元素外)直接化合,但有些反应需要加热,反应还比较剧烈,但反应活性不如氟。
一般能与氯反应的金属(除了贵金属)和非金属同样也能与溴、碘反应,只是反应的活性不如氯,要在较高的温度下才能发生。
(2)与水、碱的反应
a. 卤素对水的氧化作用
X2 + H2O
 2H+ +
2X- + 1/2O2 2H+ +
2X- + 1/2O2
事实上,F2无论在酸、水、碱中均猛烈作用放出氧气;Cl2只有在光照下,才能缓慢使水氧化。Cl2、Br2、I2在碱性介质中实际进行另一类反应—歧化反应。
b. 卤素在水中的歧化(水解作用)
X2 + H2O
 H+ +
X- + HXO H+ +
X- + HXO
除氟外,氯、溴、碘都能发生这类反应。这是一个可逆平衡,碱性介质有利于氯、溴和碘的歧化反应。
X2 + 2OH-  X-
+ X0- + H2O (X=Cl2、Br2)
X-
+ X0- + H2O (X=Cl2、Br2)
3I2 +
6OH-  2I- + IO3-
+ 3H2O 2I- + IO3-
+ 3H2O
(3)与饱和烃及不饱和烃的反应(碘除外)
氯可与饱和烃反应,取代其中的氢,生成氯化氢。而与不饱和烃反应发生加成反应。卤代作用由氟得碘逐渐变弱。

一:物理性质
卤化氢皆为无色、有刺鼻臭味的气体、在空气中会“冒烟"。这是因为卤化氢与空气中的水蒸气结合形成了酸雾。下表列举了卤化氢和氢卤酸的一些比较重要的性质。
| 性
质 |
氟化氢
(HF) |
氯化氢
(HCl) |
溴化氢
(HBr) |
碘化氢
(HI) |
| 熔
点(K) |
189.61 |
158.94 |
186.28 |
222.36 |
| 沸点(K) |
292.67 |
188.11 |
206.43 |
237.80 |
| 生成热(kJ/mol) |
-271.1 |
-92.31 |
-36.40 |
+26.5 |
| 在1273K的分解率(%) |
- |
0.014 |
0.5 |
33 |
溶解度
(100kPa) |
g/100g水,237K |
∞ |
82.3 |
221 |
234(283K) |
| %,293K |
35.3 |
42 |
49 |
57 |
| 0.1mol/L水溶液的表观电离度(%,291K) |
10 |
92.6 |
93.5 |
95 |
气态分子偶极矩
(×10-30c·m) |
6.37 |
3.57 |
2.67 |
1.40 |
| 气态分子内两原子的核间距(pm) |
92 |
128 |
141 |
162 |
| 键能(kJ/mol) |
565.0 |
428.0 |
362.0 |
295.0 |
| 气化热(kJ/mol) |
30.31 |
16.12 |
17.62 |
19.77 |
| 溶解热(kJ/mol) |
61.55 |
74.90 |
85.22 |
81.73 |
从表中可以看出,卤化氢的性质依HCl-HBr-HI的顺序有规律地变化着,例如,它们的熔点、沸点随着分子量的增加而升高,但氟化氢在很多性质上表现出例外,因分子间形成氢键,它的熔点、沸点和气化热特别高。
卤化氢都是极性分子,它们都易溶干水,水溶液称为氢卤酸。氢卤酸的酸性从HF-HCl-HBr-HI依次增强。除了HF外都是强酸。
二:化学性质
卤化氢和氢卤酸的化学性质主要包括下列几方面的内容:
(1)热稳定性
卤化氢或氢卤酸的热稳定性按HF-HCl-HBr-HI的顺序依次减弱。所谓热稳定性强弱,一般认为是用热能来打开卤素和氢之间键的难易。键能越大,键越难打开,稳定性就越强。HF的键能是HX中最大的,而且按HF-HCl-HBr-HI的顺序,键能依次减少,所以它们的热稳定性也依次减弱。
(2)还原性
卤化氢或氢卤酸的还原性,实际上是指HX失电子的能力:
HX - e  1/2X2
+ H+
1/2X2
+ H+
大量事实证明,卤离子的还原性按F-Cl-Br-I的顺序依次增强。这可从卤素的电负性加以解释。电负性越大,卤原子吸引已得来的电子就越牢,若再失去就不容易,卤离子的还原性也就弱。而卤素电负性按F-Cl-Br-I的顺序依次减弱,因而X-离子的还原性依次增强。
(3)酸性
除HF外,它们均为强酸,且酸性按HCl-HBr-HI的顺序依次增强。氢卤酸的强度从热力学角度分析可以得到满意的说明。根据△Gθ=△Hθ-T△Sθ,其中△Hθ可以通过下列热力学循环实现:
其中:
△H1θ为HX的去水化焓(与水化焓的数值相同,符号相反)
△H2θ为HX的离解能(D),也称键能
△H3θ为H的电离势(I)
△H4θ为X的电子亲合势(A)
△H5θ为H+的水合焓
△H6θ为X-的水合焓
把上述各项数据代入上式可算出△Hθ的数值。现将△Hθ,过程的熵变△Sθ和能量项T△Sθ以及由它们计算出的自由能变化△Gθ,再根据△Gθ=-RTlnK关系式算出的Ka值,一并列于下表中。
|
名称 |
△Hθ
(kJ/mol) |
△Sθ
(kJ/mol·K) |
T△Sθ(T=298K)(kJ/mol) |
△Gθ
(kJ/mol) |
Ka |
|
HF |
-14 |
-0.097 |
-29 |
+15 |
2.3×10-3 |
|
HCl |
-60 |
-0.044 |
-13 |
-47 |
1.7×108 |
|
HBr |
-64 |
-0.013 |
-4 |
-60 |
3.3×1010 |
|
HI |
-58 |
-0.013 |
+4 |
-62 |
7.4×1010 |
由上表数据可充分说明氢卤酸的酸性变化规律.

卤化物一般是指卤素和其它元素组成的二元化合物。周期表中的元素除氦、氖、氩外,均可和卤素组成卤化物。
一、卤化物的分类
卤化物既可根据组成元素的不同,分为金属卤化物和非金属卤化物,也可根据它们的性质不同分为离子型(盐型)卤化物和共价型(分子型)卤化物。非金属卤化物都是共价型卤化物,金属卤化物的情况则比较复杂。
1.非金属卤化物
硼、碳、硅、氮、磷、硫等非金属都能与卤素形成卤化物,所有的非金属卤化物都是共价型卤化物。它们的分子间作用力是微弱的范德华力,所以,这类卤化物大多数易挥发,有较低的熔点和沸点,有的不溶于水(如CCl4,SF6),溶于水的往往发生强烈水解。同一非金属与不同卤素的化合物,其熔、沸点按F-Cl-Br-I的顺序依次增高。这主要是由于非金属卤化物之间的范德华力随分子量增加而增大的缘故。
2.
金属卤化物
金属卤化物可以看成是氢卤酸的盐,它们一般具有熔、沸点高,易导电的特性。因为它们基本属于离子晶体,晶格能较大,熔融时以自由移动的离子存在。碱金属、碱土金属、大多数镧系元素和锕系元素以及低价金属离子所组成的卤化物均属此类。
金属卤化物的性质又随着金属电负性、离子半径、电荷以及卤素本身的电负性而有很大的差异。随着金属离子半径减小和氧化数增大,同一周期各元素的卤化物自左向右离子性依次降低,共价性依次增强。而且,它们的熔点和沸点也依次降低。同一主族从上到下,金属离子半径增大、电负性减小,从而形成离子型卤化物的趋势逐渐增大。
同一金属的卤化物随着卤离子半径的增大,变形性也增大,按F-Cl-Br-I的顺序其离子性依次降低,共价性依次增加。一般地说,金属氟化物主要是离子型化合物,其它卤化物从氯到碘共价型化合物则逐渐增多。
具有多种价态的同一金属,它的高氧化态卤化物的离子性要比其低氧化态的小。一般高价态形成的卤化物为共价型,低价态形成的卤化物为离子型。例如FeCl2显离子性,而FeCl3的熔点(555K)和沸点(588K)都很低,易溶解在有机溶剂中,说明FeCl3基本上是共价型的化合物.
一些常见氯化物的熔沸点见下表。
|
ⅠA
|
ⅡA
|
ⅢB
|
ⅣB
|
ⅤB
|
ⅥB
|
ⅧB
|
ⅧB
|
ⅠB
|
ⅡB
|
ⅢA
|
ⅣA
|
ⅤA
|
ⅥA
|
ⅦA
|
|
LiCl |
BeCl2 |
|
|
|
|
|
|
|
|
|
|
BCl3 |
CCl4 |
NCl3 |
Cl2O7 |
ClF |
|
883
|
678
|
|
|
|
|
|
|
|
|
|
|
166
|
250
|
-
|
192
|
117
|
|
1655
|
820
|
|
|
|
|
|
|
|
|
|
|
285
|
350
|
344
|
-
|
173
|
|
NaCl |
MgCl2 |
|
|
|
|
|
|
|
|
|
|
ACl3 |
SiCl4 |
PCl5 |
S2Cl2 |
Cl2 |
|
1074
|
987
|
|
|
|
|
|
|
|
|
|
|
465
|
205
|
181
|
193
|
|
|
1686
|
1691
|
|
|
|
|
|
|
|
|
|
|
453*
|
216
|
349
|
411
|
239
|
|
KCl |
CaCl2 |
ScCl3 |
TiCl4 |
VCl5 |
CrCl2 |
MnCl2 |
FeCl2 |
CoCl2 |
NiCl2 |
CuCl2 |
ZnCl2 |
GaCl3 |
GeCl4 |
AsCl3 |
SeCl4 |
BrCl3 |
|
1043
|
1055
|
1212
|
248
|
247
|
1088
|
923
|
950
|
997
|
1274
|
703
|
548
|
351
|
224
|
257
|
578
|
|
|
1680
|
-
|
-
|
409
|
425
|
-
|
1463
|
-
|
-
|
-
|
-
|
1029
|
|
|
403
|
469*
|
|
|
RbCl |
SrCl2 |
YCl3 |
ZrCl4 |
NbCl5 |
MoCl5 |
|
RuCl3 |
RhCl3 |
PdCl2 |
AgCl |
CdCl2 |
InCl3 |
SnCl4 |
SbCl3 |
TeCl4 |
ICl |
|
990
|
1148
|
973
|
710 |
483 |
467 |
|
|
|
|
728 |
841 |
859 |
240 |
346 |
497 |
300 |
|
1654
|
-
|
-
|
604* |
519 |
541 |
|
|
|
|
1830 |
1253 |
|
387 |
494 |
661 |
|
|
CsCl |
BaCl2 |
LaCl3 |
HfCl4 |
TaCl5 |
WCl5 |
ReCl |
OsCl4 |
IrCl4 |
PtCl4 |
AuCl3 |
HgCl2 |
TlCl |
PbCl2 |
BiCl3 |
|
|
|
918
|
1235
|
1143
|
705 |
484 |
521 |
|
|
|
|
|
550 |
702 |
774 |
505 |
|
|
|
1573
|
-
|
-
|
604* |
508 |
549 |
|
|
|
|
|
577 |
1079 |
1223 |
714 |
|
|
|
离子型 |
共价型 |
离子型 |
共价型 |
注:
表中第一行数据为熔点,第二行为沸点.此表是人为地以沸点673K作为离子型和共价型化合物的分界线.*表示在此温度时,氯化物已升华.
二:卤化物的水解反应
卤化物与水作用是卤化物最特征的一类反应。离子型卤化物大多数易溶于水,在水中电离成金属离子和卤离子。共价型卤化物绝大多数遇水立即发生水解反应。如:
BF3 + 3H2O
 H3BO3
+ 3HF H3BO3
+ 3HF
SiCl4 + 4H2O
 H4SiO4
+ 4HCl H4SiO4
+ 4HCl
PCl3 + 3H2O
 H3PO3
+ 3HCl H3PO3
+ 3HCl
BrF5 + 3H2O
 HBrO3
+ 5HF HBrO3
+ 5HF
一般生成相应的含氧酸和氢卤酸。这个过程通常认为是相对带负电的亲核体(即水中的氧原子)进攻卤化物中相对带正电的原子(例如中心原子),然后消去小分子(HX),依次逐步进行而实现的。
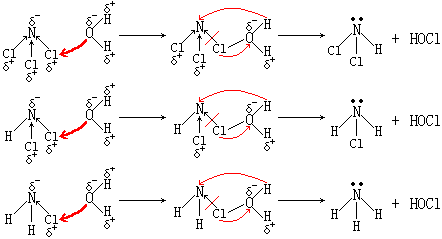
NCl3的水解反应如下:
NCl3 + 3H2O
 NH3
+ 3HClO NH3
+ 3HClO
其机理如下:
事实上生成的NH3又被HClO氧化为N2,故总反应是:
2NCl3 + 3H2O
 N2
+ 3HClO + 3HCl N2
+ 3HClO + 3HCl
但也有些卤化物在通常条件下是不水解的,如NF3,CCl4,SF6。C和Si同属ⅣA族元素,其氯化物性质为什么有这样大的差别?从热力学上看:
CCl4 + 2H2O(l)
 CO2
+ 4HCl △Gθ=-232.3kJ/mol CO2
+ 4HCl △Gθ=-232.3kJ/mol
SiCl4 + 2H2O(l)
 SiO2
+ 4HCl △Gθ=-140.5kJ/mol SiO2
+ 4HCl △Gθ=-140.5kJ/mol
两者都应水解,而且CCl4的趋势更大,然而通常条件下CCl4是不水解的。这是因为C是第二周期元素,外层2s、2p轨道参加成键,最大配位数为4,而水解前C的配位数已达饱和,不能再接受H2O中的孤对电子而与H2O分子配位。另外加上C-Cl键能较大,CCl4分子对称性强等因素,使得通常条件下CCl4不水解。同理,SF6分子中的中心S原子(第三周期元素)尽管有可利用的d轨道,但它的配位数已达饱和(为6),水分子同样不能进攻,因此SF6也是一个不水解的共价型卤化物。

由两种卤素组成的二元化合物称为卤素互化物。用XXn1表示。其中n为1、3、5、7(n的值随rx/rx'和中心卤原子X的氧化数的增大而增加),X'的电负性比X的大,由于它们都是卤素,电负性的差值不会很大,所以它们之间都是以共用电子对相结合而形成的共价化合物,这类物质的键能和熔沸点列于下表中。
|
类 型 |
化合物 |
性 状 |
平均键能
(kJ/mol) |
熔 点
(K) |
沸 点
(K) |
|
XX' |
ClF |
无色稳定气体 |
248 |
117.5 |
173 |
|
BrF |
红棕色气体 |
249 |
240 |
293 |
|
IF |
很不稳定歧化为IF5和I2 |
277.8 |
- |
- |
|
BrCl |
红色气体 |
216 |
207 |
278 |
|
ICl |
暗红色固体 |
208 |
300.5 |
370 |
|
IBr |
暗灰紫色固体 |
175 |
309 |
389 |
|
XX3' |
ClF3 |
无色稳定气体 |
172 |
197 |
285 |
|
BrF3 |
稳定浅黄绿色液体 |
201 |
282 |
401 |
|
IF3 |
黄色固体 |
~272 |
245(分解) |
|
|
ICl3 |
橙色固体 |
- |
384(分解) |
|
|
IBr3 |
棕色液体 |
- |
- |
- |
|
XX5' |
ClF5 |
稳定固体(在78K以下) |
142 |
170 |
260 |
|
BrF5 |
无色稳定液体 |
187 |
212.6 |
314.4 |
|
IF5 |
无色稳定液体 |
268 |
282.5 |
377.6 |
|
XX7' |
IF7 |
无色稳定液体 |
231 |
279(升华) |
277.5 |
XXn'的化学活泼性比X2的大(除F2外),绝大多数不稳定。它们是氧化剂,反应类型与卤素单质相似。它们和大多数金属、非金属生成相应的卤化物,水解时产生的卤离子和卤氧离子,卤氧离子由分子中半径较大的卤原子组成:
ICl + H2O  HCl
+ HIO(或HIO3)
HCl
+ HIO(或HIO3)
BrF5 + 3H2O
 5HF
+ HBrO3 5HF
+ HBrO3

金属卤化物与卤素单质或卤素互化物加合所生成的化合物称为多卤化物。多卤化物通常是离子化合物。如:
KI + I2  KI3
KI3
CsBr + IBr  CsIBr2
CsIBr2
多卤化物可以是一种卤素,也可以是多种卤素。常见的固态多卤化物有:KI3·H2O、CsI5、RbI7·H2O、KI9、CsBr3等。由此可见,只有半径大的碱金属离子才可形成。就多卤离子来说,卤原子的总数为3、5、7、9,有的还带结晶水。这类化合物稳定性差,当受热时可以生成简单的金属卤化物和卤素单质或卤素互化物:
CsBr3  CsBr
+ Br2
CsBr
+ Br2
CsICl2  CsCl
+ ICl
CsCl
+ ICl
多卤阴离子的结构都是已知的。I3-、Br3-,ICl2-、IBrCl-等几乎是直线型。这类化合物的结构也可用价层电子对互斥理论说明。

下面主要讨论卤素含氧酸及其盐在酸性、氧化性和稳定性方面的变化规律。
一:酸性
|
|
酸性依次增强
 |
|
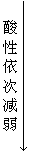
|
HClO |
HClO2 |
HClO3 |
HClO4 |
|
3.0×10-8 |
1.1×10-2 |
101 |
108 |
|
HBrO |
HBrO2 |
HBrO3 |
HBrO4 |
|
2.1×10-9 |
- |
- |
- |
|
HIO |
- |
HIO3 |
H5IO6 |
|
2.3×10-11 |
- |
1.7×10-1 |
5.1×10-4(K1) |
由上表结果可见,同一卤素不同氧化态的含氧酸,其酸性随着氧化数的增加而增大;同一卤族不同元素(氧化态相同)形成的含氧酸,其酸性按从上到下的顺序依次减弱。
上述规律也适用于其它主族元素的含氧酸。
二:氧化性
卤素含氧酸及其盐的氧化性的规律是:
(1)同一元素随着卤原子氧化数的增高,氧化能力依次减弱。如氧化性:
HClO>HClO2>HClO3>HClO4
(2)同一氧化态的不同卤素,低氧化态含氧酸,其氧化能力按Cl-Br-I的顺序依次减弱,如:HClO>HBrO>HIO。其中溴的有些出现反常,如:HClO3<HBrO3>HIO3。
(3)卤素在酸性溶液中的Eθ都比它们在碱性溶液中的Eθ大,说明含氧酸的氧化性比其盐的都要强。
三:稳定性
卤素含氧酸及其盐的稳定性与它们的氧化能力有对应关系,一般氧化能力弱,稳定性就高,反之,氧化能力强,稳定性就低。并且含氧酸也比对应的含氧酸更加稳定。

|