|
一:物理性质
氯气是一种浅黄色的气体,在标准状态下,1升氯气重3.21克,大约是同体积空气质量的2.5倍。氯气极易液化,冷却至239K或常温时在0.6MPa下,氯气变为黄绿色油状液体,液氯在172K还可凝固成黄色固体。
氯是一种非常活泼的非金属,其单质是很强的氧化剂。在氯的化学反应中,氯可以表现出由-1到+7的多种氧化态。
二:化学性质
(1) 与金属,非金属的作用
氯气能与各种金属和大多数非金属(除氮、氧、希有元素外)直接化合,但有些反应需要加热,反应还比较剧烈,如钠、铁、锡、锑、铜等都能在氯中燃烧。潮湿的氯在加热条件下能与金、铂反应,干燥的氯却不与铁作用,故可将干燥的液氯贮于钢瓶中。氯与非金属反应的剧烈程度不如氟。
Cl2 + 2Na  2NaCl
2NaCl
Cl2 + Cu  CuCl2
CuCl2
3Cl2 + 2Au  2AuCl3
2AuCl3
2P(过量) + 3Cl2  2PCl3 2PCl3
2P + 5Cl2(过量)  2PCl5 2PCl5
Cl2 + F2  2ClF
2ClF
3Cl2 + I2  2ICl3
2ICl3
(2) 与水、碱的反应
常温下一体积的水可以溶解约2.5倍体积的氯气,这种溶液叫氯水.
Cl2 + H2O
 HCl + HClO HCl + HClO
Cl2与水的反应是歧化反应,但在纯水中该反应进行的程度只约占三分之一。如果在碱性条件下,歧化反应进行得彻底:
Cl2 + 2OH-
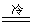 Cl-
+ Cl0- + H2O Cl-
+ Cl0- + H2O
(3) 与饱和烃及不饱和烃的反应
氯可与饱和烃反应,取代其中的氢,生成氯化氢。而与不饱和烃反应发生加成反应。如可与甲烷、乙烯等发生如下的反应:
CH4 +
Cl2
 CH3Cl +
HCl(氢可逐步被取代) CH3Cl +
HCl(氢可逐步被取代)
CH2=CH2
+ Cl2
 CH2Cl-CH2Cl CH2Cl-CH2Cl
氯气甚至能同某些有机物(如松节油等)中的氢反应,生成氯化氢。
C10H16
+ 8Cl2
 16HCl + 10C 16HCl + 10C

氯化氢为无色、有刺鼻臭味的气体、在空气中会“冒烟",这是因为氯化氢与空气中的水蒸气结合形成了酸雾。氯化氢的熔点158.94K,沸点188.11K,在水中极易溶解,在273K时,1体积的水可溶解500体积的氯化氢,其水溶液称为盐酸。
氯化氢为极性分子,其水溶液盐酸为强酸。市售的浓盐酸浓度为37%,约为12mol/L。氯化氢或盐酸在常温下很稳定,也都具有一定的还原性。

氯与氧形成的氧化物有Cl2O、ClO2、Cl2O6和Cl2O7四种,它们都是强的氧化剂,不稳定易分解(爆炸)。
一:Cl2O
Cl2O是黄红色气体。通氯气于新鲜沉淀的HgO上,即得到Cl2O。
2Cl2 + 2HgO
 HgO·HgCl2 +
Cl2O HgO·HgCl2 +
Cl2O
Cl2O气体在293K以上便分解,在275K时变为更不稳定的红色液体。Cl2O是次氯酸的酸酐。
二:ClO2
ClO2在室温下是黄红色的气体,熔点214K,沸点283K。无论是在气态或液态均极易爆炸,氧化性很强,能氧化许多有机物和无机物。浓硫酸与氯酸盐接触即得到ClO2,因ClO2不稳定易发生分解(爆炸).
3ClO3- +
2H+  ClO4- +
2ClO2 + H2O ClO4- +
2ClO2 + H2O
较安全的制备ClO2方法,是在溶液中用硫酸与二氧化硫来处理氯酸钠.
2ClO3-
+ SO2 + H+  2ClO2 +
HSO4-
2ClO2 +
HSO4-
大量用此法制得的ClO2,用于作纸浆的漂白剂。ClO2的分子是V形(1180)结构,Cl-O间距147pm,是奇电子化合物。
三:Cl2O6
Cl2O6是暗红色液体,熔点277K、沸点476K。将臭氧与ClO2在273K条件下反应可制得Cl2O6。
ClO2 + O3
 ClO3 +
O2 ClO3 +
O2
在液态和固态下,ClO3和Cl2O6共存,只有在蒸气状态时,才全部是ClO3。Cl2O6与碱反应而生成两种盐:
Cl2O6 +
2KOH  KClO3
+ KClO4 + H2O KClO3
+ KClO4 + H2O
四:Cl2O7
Cl2O7是无色油状液体,熔点182K、沸点355K。在低温(263K)时,将HClO4小心地加入P4O10中进行脱水,然后蒸馏就得到Cl2O7液体,它是高氯酸的酸酐。

一:次氯酸
次氯酸是一元弱酸,Ka=3.0×10-8,仅存在于溶液中,不稳定,其分解方式有两种:
(1) 在室温或光照射下:
2HClO  2HCl +
O2 2HCl +
O2
(2) 加热下:
3HClO  3H+ +
2Cl- + ClO3- 3H+ +
2Cl- + ClO3-
HClO的杀菌、漂白作用就是利用第一个分解反应来实现。由氯元素的电势图可知,在酸性和碱性介质中,HClO都可发生歧化反应。如在室温时ClO-的歧化反应速度极慢,当加热到~350K时,反应速度急剧加快,产物是ClO3-和Cl-。
二:次氯酸盐
次氯酸盐中比较重要的是次氯酸钠和次氯酸钙。它们都是强氧化剂。NaClO易水解,溶液显碱性.
NaClO + 2HCl(浓)  NaCl + Cl2
+ H2O NaCl + Cl2
+ H2O
NaClO + 2NaOH + MnSO4  MnO(OH)2↓+
NaCl + Na2SO4 MnO(OH)2↓+
NaCl + Na2SO4
NaClO + H2O  HClO + NaOH HClO + NaOH
用氯与Ca(OH)2反应,则生成大家所熟知的漂白粉,该反应在298K进行。
2Cl2 + 2Ca(OH)2
 Ca(ClO)2 +
CaCl2 + 2H2O Ca(ClO)2 +
CaCl2 + 2H2O
漂白粉是次氯酸钙、氯化钙和氢氧化钙所组成的水合复盐。次氯酸钙是漂白粉的有效成分。加硫酸或盐酸于漂白粉上即有氯气发生:
Ca(ClO)2 + 4HCl
 CaCl2 +
2Cl2 + 2H2O CaCl2 +
2Cl2 + 2H2O
漂白粉在空气中放置时,会逐渐失效,这是因为它与空气中的碳酸气作用而生成HClO,而HClO不稳定立即分解。
Ca(ClO)2 + H2O +
CO2  CaCO3 + 2HClO CaCO3 + 2HClO

在亚氯酸钡悬浮液中加入稀H2SO4,除去BaSO4沉淀,就可得到亚氯酸水溶液。它极不稳定会迅速分解。
HCl02  3Cl02 +
1/2Cl2 + 2H2O
3Cl02 +
1/2Cl2 + 2H2O
它是弱酸(Ka=10-2)但酸性比HClO强。当ClO2和碱溶液反应时生成亚氯酸盐和氯酸盐。
2Cl02 + 20H-
 Cl02- +
Cl03- + H2O Cl02- +
Cl03- + H2O
用ClO2和Na2O2反应可制得NaClO2,
Na2O2 +
2ClO2  2NaClO2
+ O2 2NaClO2
+ O2
亚氯酸盐比亚氯酸稳定,如把亚氯酸盐的碱性溶液放置一年也不见分解,但加热或敲击亚氯酸盐固体时立即发生爆炸,歧化成为氯酸盐和氯化物。
3NaClO2  2NaClO3
+ NaCl
2NaClO3
+ NaCl
亚氯酸及其盐具有氧化性可作漂白剂。

氯酸是强酸,其稳定性不如HBrO3和HIO3。HClO3只存在于水溶液中,未得到过纯酸,它的浓度若超过40%就会迅速分解并发生爆炸:
8HClO3  3O2
+ 2Cl2 + 4HClO4 + 2H2O
3O2
+ 2Cl2 + 4HClO4 + 2H2O
氯酸及其盐在酸性介质中都是强氧化剂,如能氧化Cl-,Br-和I-为单质:
ClO3- + 5X-
+ 6H+  3X2
+ 3H2O(X=Cl,Br,I) 3X2
+ 3H2O(X=Cl,Br,I)
反应的平衡常数如下: KCl=2×109, KBr=1×1038,
KI=1.6×1044
另外,氯酸盐还能氧化I2为HIO3:
2ClO3- +
2H+ + I2  2HIO3
+ Cl2 2HIO3
+ Cl2
在碱性介质中,卤酸盐的氧化能力则相当弱。
氯酸盐中最常见的是KClO3和NaClO3。NaClO3易潮解而KClO3不会吸潮可制得干燥产品。利用KClO3溶解度较小的特点,让NaClO3与KCl进行复分解反应可得到KClO3。
NaClO3 + KCl  KClO3 + NaCl
KClO3 + NaCl
在有催化剂存在下,KClO3分解为氯化钾和氧,若不存在催化剂,则KClO3在629K时熔化,668K时开始按下式分解:
4KClO3  KCl +
3KClO4
KCl +
3KClO4
氯酸盐的热分解产物与组成盐的阳离子性质有关。例如碱金属,碱土金属和Ag+的氯酸盐其分解产物为氯化物和O2;Cd2+,Pb2+,Ni2+等氯酸盐的分解产物除了Cl2,O2外还有氯化物和氧化物;而Cu2+,Co2+,Zn2+等的分解产物为氧化物,Cl2和O2。
16Pb(ClO3)2  14PbO2
+ 2PbCl2 + 11Cl2 + 6ClO2 + 28O2
14PbO2
+ 2PbCl2 + 11Cl2 + 6ClO2 + 28O2
2Zn(ClO3)2
 2ZnO
+ 2Cl2 + 5O2 2ZnO
+ 2Cl2 + 5O2
固体KClO3是强氧化剂,它与易燃物质如碳、硫、磷及有机物质相混合时,一受撞击即猛烈爆炸,因此,氯酸钾大量用于制造火柴、焰火等。

无水高氯酸是无色液体,不稳定,贮藏时会发生爆炸,但浓度低于60%的高氯酸水溶液对热很稳定,加热也不分解。市售高氯酸的浓度为70%。
高氯酸是已知酸中最强的酸,但它的氧化性在冷的稀溶液中很弱,浓溶液则有较强的氧化性。当热的浓酸与易燃物质接触则会发生猛烈爆炸。在钢铁分析中常用HClO4溶解矿样。
在溶液中,ClO4-离子非常稳定,如SO2、H2S、Zn、Al等较强的还原剂都不能使它还原。当溶液酸化后,ClO4-的氧化性增强。ClO4-离子对金属离子的结合作用很弱,因此研究溶液中的络合物时加入高氯酸盐,可使溶液保持一定的离子强度。
固态高氯酸盐在高温下是一个强氧化剂,但其氧化能力比氯酸盐弱。用KClO4制作的炸药比用KClO3为原料的炸药稳定些。KClO4在883K时熔化,同时开始依下式分解:
KClO4  KCl
+ 2O2
KCl
+ 2O2
高氯酸盐一般是可溶的,但Cs+、Rb+、K+及NH4+的高氯酸盐的溶解度都很小。

|