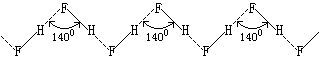|
虽然卤素的性质具有差异性,但氟与其它卤素间的差异尤为显著。主要表现在:
(1)氟原子电子亲合势反常的比氯的小
这是因为氟原子的半径很小,核周围的电子云密度较大,当它接受外来一个电子时,电子间的斥力较大,这一斥力部分地抵消了氟原子获得一个电子成为氟离子时所放出的能量,使氟的电子亲合势反而比氯的电子亲合势小(放出能量小)。 (2)F2的离解能小于Cl2
原因同上。 (3)是最强氧化剂
氟的电负性是所有元素中最大的,因此在氟化物中氟的氧化数总为-Ⅰ。F-水合能较大,F2离解能小,所以氟在卤素中仍是最强的氧化剂,能从溶液或固态下置换Cl-离子。从下面列出的F2和Cl2形成离子时过程的焓变数据可得到阐明。
(4)氟化物键能大
氟与其它元素化合生成氟化物时其键能均较相应的氯化物大,这是由于其它元素原子半径较大或它的最外电子层没有孤对电子,则电子之间的斥力减小了,于是氟原子半径较小这一因素占优势,氟化物与其它相应的卤化物比较总是最稳定的。此外,与氟化合的元素常常表现出其最高氧化态。

由于氟原子半径很小,电负性很大,使得该元素的性质与同族的氯、溴、碘差异较大,因此形成的氟化物(无论是共价型还是离子型)也存在着许多特殊性,主要表现在:
(1)键能大
卤素和其它元素所形成的共价化合物中,唯有氟化物的键能最大。下表列出一些卤化物的平均键能(kJ/mol)。
|
名 称 |
HX |
BX3 |
AlX3 |
CX4 |
SiX4 |
AsX3 |
|
F |
565 |
613 |
583 |
485 |
565 |
484 |
|
Cl |
428 |
456 |
420 |
327 |
381 |
321 |
|
Br |
362 |
377 |
- |
285 |
310 |
258 |
|
I |
295 |
- |
- |
213 |
234 |
200 |
从表中数据看出,氟化物的键能不仅是在卤素同类化合物中最大,而且还大得多。这说明氟化作用一旦发生,就将比其它卤素的卤化作用进行得彻底,放出的能量也最多。事实上,有些卤化反应只有氟化反应才能进行,这在有机合成上有特殊的意义。
(2)离子化合物的晶格能高
决定离子化合物晶格能大小的主要因素是阴阳离子半径、电荷和晶型。对选定的阳离子和同一晶型的卤素离子化合物、晶格能由X-离于半径决定.F-离子半径最小,离子的水合能大,因此氟化物的晶格能最大。
(3)易形成配合物
在卤离子中,F-离子半径最小,它容易和电荷高、半径小的阳离子形成高配位数的配阴离子。如BF4-、SiF62-、AlF63-、FeF63-等。这些配离子主要靠静电引力结合。其它卤离子半径较大,难以形成类似的配离子。相反,这些卤离子能以共价形式结合形成象HgI42-,AgCl2-、AuCl63-,CuBr32-等稳定的配离子,而F-却因变形性小难以充当这类配离子的配位体。
(4)溶解性特殊
AgX中只有AgF易溶于水,这主要是因为它是离子型化合物,而有别于其它。在离子化合物CaX2中,因CaF2的晶格能特别大,水分子难以把它拉开,故CaF2是难溶化合物,而其它卤化钙则易溶。
(5)毒性大
氟化物均有毒,误食0.15g的NaF就会造成严重疾病,若量多,则会引起死亡。氟化物水解后产生的氢氟酸具有很强的腐蚀性。它对细胞组织、骨骼都有严重的破坏作用,对皮肤有难以治愈的创伤。然而少量(如食用水中含1~2mg/L)氟离子能防止儿童牙龋,市售氟化锶牙膏有防治牙龋作用就是一例。

一:物理性质
氟是最活泼的非金属元素,氟单质是目前已知的最强的氧化剂,所以自然界中只有氟的化合物存在。单质氟在常温下是淡黄色气体,剧毒,熔点为53.38K,沸点84.86K,密度1.11g/cm3。遇水猛烈反应,放出氧气。
氟对于维持正常的生长是必需的。机体摄入的氟过少,可能引起龋齿,过多则可能导致氟骨病和斑釉齿。
二:化学性质
(1)与金属,非金属的作用
氟能与所有金属和非金属(除氮、氧和一些希有气体外)包括氢直接化合,而且反应常常是很猛烈的,伴随着燃烧和爆炸。氟与单质的反应总是得到最高氧化态的氟化物。在室温或不太高温度下,氟与镁、铁、铜、铅、镍等金属反应,在金属表面形成一层保护性的金属氟化物薄膜,可阻止氟与金属进一步的反应。在室温时氟与金、铂不作用,加热时则生成氟化物。
(2)与水、碱的反应
氟不溶于水,但与水剧烈反应放出氧气:
2F2 +
2H2O  4HF + O2 4HF + O2
氟与碱的反应和其它卤素不同,其反应如下:
2F2
+ 2OH-(2%)  2F-
+ OF2 + H2O 2F-
+ OF2 + H2O
当碱溶液较浓时,则OF2被分解放出O2。
2F2 +
4OH-  4F- + O2
+ 2H2O 4F- + O2
+ 2H2O

一:
氟化氢
氟化氢是极性分子,在293K时能无限制地溶于水中,原因是它同水形成氢键。氟化氢的水溶液称为氢氟酸。
氟化氢的熔点、沸点和气化热特别高是因为其分子间存在氢键的缘故。实验证明,氟化氢在气态、液态和固态时都通过氢键形成不同程度的缔合。在360K以上它的蒸气密度相当于HF,在299K时相当于(HF)2和(HF)3的混合物。在固态时,氟化氢由无限长的锯齿形长链组成。
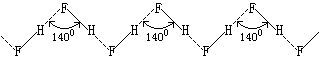
二:氢氟酸
氢氟酸是一弱酸(298K时,Ka=3.5×10-4)。与其它弱酸相同,浓度越稀,HF电离度越大。但溶液浓度增大时,HF2-离子增多。因为在氢氟酸溶液尤其是浓溶液中,一部分F-离子通过氢键与未离解的HF分子形成缔合离子,如HF2-、H2F3-、H3F4-等,其中HF2-离子特别稳定。
HF + F-  HF2- K=5.1
HF2- K=5.1
稀溶液: HF + H2O  H3O+ + F-
Ka=3.5×10-4
H3O+ + F-
Ka=3.5×10-4
浓溶液: 2HF + H2O  H3O+ +
HF2-
H3O+ +
HF2-
HF2-离子是一弱碱,比水合F-离子稳定,使上式平衡向右移动从而使氢氟酸的电高度增大。当浓度大干5mol·L-1时,氢氟酸已经是相当强的酸。用碱中和氢氟酸溶液能生成酸式盐如KHF2也说明HF2-离子的稳定性。
氢氟酸的另一个特殊性质是它能与二氧化硅或硅酸盐反应生成气态SiF4。
SiO2 + 4HF
 SiF4 +
2H2O SiF4 +
2H2O
CaSiO3 + 6HF
 CaF2 +
SiF4 + 3H2O CaF2 +
SiF4 + 3H2O
液态氟化氢有微弱的自偶电离:
2HF  H2F+ +
F- K≈10-10
H2F+ +
F- K≈10-10
它的介电常数(84)和水(81)相仿,是一种有用的溶剂,能溶解很多无机物和有机物。

二氟化氧OF2是无色气体,是强氧化剂,与金属,硫,磷,卤素等剧烈反应生成氟化物和氧化物。
把单质氟通入2%NaOH溶液中可制得OF2:
2F2 + 2NaOH  2NaF + H2O
+ OF2 2NaF + H2O
+ OF2
OF2溶于水可得中性溶液,溶解在NaOH溶液中可得F-和氧气,它不是酸酐。

|