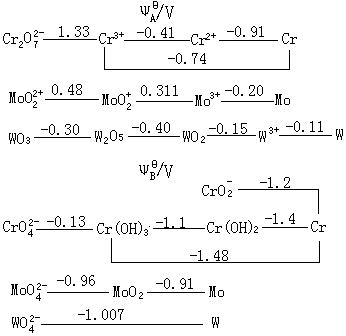|
一:铬族元素基本性质 第ⅥB族即铬族包括铬、钼和钨三种元素,它们元素的基本性质见下表:
二:铬族元素的通性 铬族元素的价电子构型为(n-1)d5ns1,其中钨为5d46s2。6个价电子都可以参与成键,因此它们的最高氧化态为+6,与族数一致。和所有d区元素一样,它们的d电子也可以部分参与成键,因此铬族元素具有多种氧化态。 铬的氧化态有+Ⅱ、+Ⅲ、+Ⅵ,但最稳定的氧化态是+Ⅲ。而Mo和W以+Ⅵ氧化态最稳定。所以铬族元素自上而下,高氧化态趋于稳定,而低氧化态的稳定性减弱。 三:铬族元素电势图 铬族元素的标准电势图如下:
一:物理性质 铬是银白色有光泽的金属,粉末状的钼和钨是深灰色的,而致密的块状钼和钨才是银白色的,且有金属光泽。由于铬分族元素在形成金属键时可提供6个电子,形成较强的金属键,因此,它们的熔点和沸点是同一周期中最高的一族。钨的熔点和沸点是所有金属中最高的。另外,铬族元素的硬度也都很大。 二:化学性质 从标准电极电势看,铬还原性比较强,而钼和钨则比较稳定。铬与空气接触则很快变成绿色,而钼和钨在常温下不与大多数非金属作用,但钼与氟剧烈反应,钨与氟也可反应。在高温下它们易与氧、卤素、碳及氢反应。 铬能溶于稀酸,钼只能溶于浓硝酸和王水,而钨只溶于王水或HF和HNO3的混合酸中。由此可看出:铬族金属从上到下金属活泼性逐渐减弱。
铬酸是强酸,强度接近硫酸,而钼酸和钨酸是难溶的酸,它们的酸性只有通过溶于碱才可表示出来。 在酸性条件下,重铬酸盐强氧化剂,钼酸盐氧化性较弱,只能被强还原剂所还原,而钨酸盐的氧化性就更弱了。它们+Ⅵ氧化态含氧酸的酸性和氧化性变化归纳如下:
酸性增强 H2CrO4 H2MoO4 H2WO4 ←------------------- 氧化性增强 铬酸及铬酸盐形成多酸和多酸盐的能力较弱,钼和钨形成多酸和多酸盐的趋势较强。
在形成配合物时,Cr(Ⅲ)的六配位配合物是较为突出的,而钼和钨形成配离子的能力较差,但钼和钨可形成原子簇化合物。 |