|
钼和钨是银白色、有光泽,具有体心立方结构的金属。它们的化学性质较稳定。与铬相似,它们的表面也易形成氧化膜而呈钝态。 钼和钨在常温下很不活泼,与大多数非金属不作用,但钼与氟剧烈反应,钨与氟也可反应。在高温下它们易与氧、卤素、碳及氢反应,分别得到氧化物、卤化物、间充型碳化物及氢化物。钼与硫作用,而钨不与硫反应。 钼与稀酸不反应,与浓盐酸也无反应,只有浓硝酸与王水可以与钼发生反应。钨不溶于盐酸、硫酸和硝酸,只有王水或HF和HNO3的混合酸才能与钨发生反应。由此可见,铬分族元素的金属活泼性是从铬到钨的顺序逐渐降低。
一:三氧化钼 MoO3虽然可由钼或MoS2在空气中灼烧得到,但通常是由往钼酸铵溶液中加盐酸,析出H2MoO4再加热焙烧而得到。 二:三氧化钨 三氧化钨为淡黄色粉末,加热时变为橙黄色,熔点为1746K,沸点为2023K。
同样,WO3也是酸性氧化物,也不溶于水,仅能溶于氨水和强碱溶液生成相应的含氧酸盐。
若往钼,钨酸盐中加入酸,可从溶液中析出难溶的钼酸和钨酸。它们实际上是MoO3与WO3的不同水合物,但一般常写为H2MoO4和H2WO4。 将MoO3与WO3溶于碱溶液中生成钼酸盐和钨酸盐,其中只有ⅠA族,ⅡA族的Be,Mg和ⅢA的Tl(+Ⅰ)的钼,钨酸盐可溶于水,其余皆难溶。在可溶性盐中,最重要的是它们的钠盐和铵盐。 与铬酸盐在酸性溶液中生成重铬酸盐相类似,钼酸,钨酸的盐溶液在加入强酸后也有缩合倾向,形成各种形式的多酸盐,如Mo2O72-,Mo3O102-,钨还可形成六钨酸盐Na5[HW6O21]·aq和12钨酸盐Na6[H2W12O40]·aq。
已知的硫化物中,重要的有MoS2,MoS3,Mo2S6,WS2和WS3等。MoS2在自然界以辉钼矿存在。在实验室中可用单质合成,或MO3(M=Mo,W)在H2S中加热,也可以用MO3与硫粉和K2CO3一同加热制得。在上述硫化物中以MS2最稳定,在473K时其晶体有导电性,化学性质极为惰性,仅溶于王水或煮沸的浓硫酸中。在高温下,MS2同氯、氧作用,分别生成MCl6和MO3。
前已提到在CrO42-离子的溶液中,加酸后可得Cr2O72-离子,如酸性很强还可形成Cr3O102-、Cr4O132-等多铬酸根离子。钼酸盐和钨酸盐在酸性溶液中,亦有很强的缩合倾向,且较铬酸盐更为突出。 ....................... 除上述的各种多酸外,前面已学习过的如多钒酸(如二钒酸H4V2O7、三钒酸H3V3O9),多硅酸(如焦硅酸H6Si2O7)等都属于同多酸。这些酸相应的盐称同多酸盐。如七钼酸六铵(NH4)6Mo7O24·4H2O,十二钨酸十铵(NH4)10W12O41·11H2O等。
在某些多酸中,除了由同一种酸酐组成的同多酸外,也可以由不同的酸酐组成多酸,称为杂多酸。如十二钼硅酸H4(SiMo12O40),十二钨硼酸H5(BW12O40),相应的盐称杂多酸盐。例如,向磷酸钠的热溶液溶液加入WO3达到饱和,就析出12-钨磷酸钠,它的化学式为Na3[P(W12O40)]或3Na2O·P2O5·24WO3,其中P:W=1:12。又如,把用硝酸酸化的(NH4)2MoO4溶液加热到约323K,加入Na2HPO4溶液,可得到黄色晶体状沉淀12-钼磷酸铵。
12MoO42-
+ 3NH4+ + HPO4- + 23H+
上面提到的钼、钨和磷的杂多酸及其盐常用于分析化学上,例如上述反应就可用于检定MoO42-或PO43-离子。在这些杂多酸盐中,磷(Ⅴ)是中心原子,W3O102-和Mo3O102-是配位体。在多酸中能够作为中心原子的元素很多,最重要的有V、Nb、Ta、Cr、Mo、W等过渡元素和Si、P等非金属元素。
在有些化合物如氯化亚汞中,人们早已知道该化合物的分子呈直线型,有Hg-Hg键,在一些金属和卤素形成的配离子如Mo2Cl93-、W2Cl93-、Re2Cl93-中,金属原子和金属原子之间也直接成键。通常将这种含有金属M-M键的化合物,称为原子簇化合物。
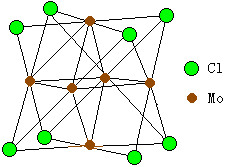
在这类化合物中,金属原子簇形成核心,周围通过多种形式的化学键与配位体结合。 有的原子簇化合物中,原子簇是由两种或两种以上的金属原子所组成。例如,Cu4Ir2(PPh3)2(C≡CPh)8,它含四个铜和两个铱原子的八面体簇。 许多过渡金属元素,如周期表中ⅤB、ⅥB、ⅦB、ⅧB族金属元素都能形成原子簇化合物,各个元素所能组成原子簇的原子数往往依照不同的配位体和结构而定。 例如,Mo、W、Nb、Ta等金属均可形成含有M6的原子簇化合物。Mo和W的二卤化物实际上其化学式应为[M6X8]X4,因为在它们的结构中,存在八面体M6金 属原子簇,八个X原子处在M6八面体的面中心的法线上,每个X原子和三个M原子形成多中心桥键,其结构如图14-3。又如Mo和W的三卤化物中,三氯化钨实际上也是一种原子簇化合物[W6Cl12]Cl6,其中[W6Cl12]6+离子含有W原子组成的八面体,12个X原子在八面体的12个棱的外侧形成桥键。Rh可组成原子数由2~17不等的原子簇。最常见的原子簇化合物除上述卤化物外,还有硫化物如Fe-S,Mo-S等原子簇,多核羰基配合物等多种类型。 |