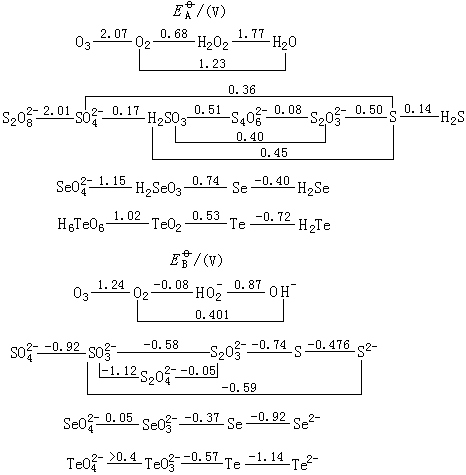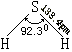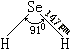|
一:氧族元素基本性质
第ⅥA族包括氧、硫、硒、碲和钋五种元素,统称为氧族元素,而硫、硒、碲又常称为硫族元素。其中钋是一种稀有的放射性元素。
氧族元素的基本性质列于下表中。
|
性
质
|
氧(O)
|
硫(S)
|
硒(Se)
|
碲(Te)
|
|
原 子 序 数
|
8
|
16
|
34
|
52
|
|
原
子 量
|
16.00
|
32.06
|
78.96
|
127.60
|
|
价电子构型
|
2s22p4
|
3s23p4
|
4s24p4
|
5s25p4
|
|
主要氧化态
|
-2,0
|
-2,0,+2,+4,+6
|
-2,0,+2,+4,+6
|
-2,0,+2,+4,+6
|
|
共价半径(pm)
|
66
|
104
|
117
|
137
|
|
离子半径(pm)
|
132
|
184
|
191
|
211
|
|
第一电离势(kJ/mol)
|
1314
|
999.6
|
940.9
|
869.3
|
|
第一电子亲合势(kJ/mol)
|
-141
|
-200.4
|
-195
|
-190.1
|
|
第二电子亲合势(kJ/mol)
|
+780
|
+590
|
+420
|
-
|
|
电
负 性
|
3.44
|
2.58
|
2.55
|
2.10
|
二:氧族元素的通性
氧族元素原子的价电子层结构ns2np4,有6个价电子,当它们和其它元素化合时,有夺取或共用两个电子以达到稀有气体原子电子层结构的倾向,表现出非金属元素的特征。但和卤素相比,它们结合两个电子不如卤素结合一个电子容易,所以本族元素的非金属性比同周期的卤素非金属性要弱。
从上表数据可看出,本族元素的原子半径、离子半径、电离势和电负性的变化规律和卤素相似。随着半径依次增大,电离势和电负性依次减小,从而使本族元素非金属性依次减弱,金属性逐渐增强。氧和硫是典型非金属;硒和碲是半金属;而钋是金属。氧的电负性仅次于氟,比硫、硒、碲的电负性要大得多,因此氧与大多数金属元素形成离子型化合物(如Na2O,CaO,Al2O3等),与非金属元素形成共价化合物;而硫、硒、碲只能与电负性较小的金属元素形成离子型化合物(如Na2S,BaS,K2Se等);与其他元素化合时主要形成共价化合物。
三:氧的特殊性
与氟原子相似,在氧族元素中氧原子的半径较小,核周围孤对电子的斥力强,氧的最外电子层没有d轨道,不能形成d-pπ键,因此氧的第一电子亲合势比硫的小,O-O单键较弱。氧在化合物(除OF2、H2O2等外)中的氧化数均为-Ⅱ。而硫、硒、碲除了有-Ⅱ氧化态外,因它们的价电子层中均有空d轨道可参加成键,则还可形成+Ⅱ、+Ⅳ、+Ⅵ氧化态,并且从硫到碲正氧化态化合物的稳定性逐渐增强。
四:氧族元素的电势图
氧族元素的标准电势图如下:

氧族元素的游离态均存在同素异性体。和硫相似,硒和碲的游离态也存在无定形和结晶形的同素异形体。无定形硒是棕红色粉末,晶态硒中最稳定的属灰硒,它们的分子均由8个硒原子组成。无定形碲为棕黑色粉末,晶态碲为银白色,在蒸气时,其分子组成为Te2。

氧族氢化物的结构与性质见下表。
|
名
称 |
水
(H2O) |
硫化氢
(H2S) |
硒化氢
(H2Se) |
碲化氢
(H2Te) |
|
气态分子结构 |
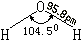
|
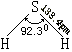
|
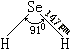
|

|
|
物理性质 |
熔点(K)
|
273 |
187 |
213 |
224 |
|
沸点(K)
|
373
|
202
|
232
|
271
|
|
热稳定性 |
H-A键能(kJ/mol)
|
458.8 |
363 |
276 |
238 |
|
生成热(kJ/mol)
|
-242
|
-20.6
|
29.7
|
99.6
|
|
溶液酸性 |
H2A=H++HA-
|
1.1×10-16 |
9.1×10-8 |
1.7×10-4 |
2.3×10-3 |
|
HA-=H++A2-
|
<10-36
|
1.1×10-12
|
≈10-10
|
≈10-5
|
|
还原性 |
A+2H++2e=H2A
Eθ/(V)
|
0.82 |
0.14 |
-0.40 |
-0.72 |
由上表中看出:氢化物的熔沸点从上到下依次增强,而水的熔沸点反常的高是因为水分子之间存在氢键的缘故.
从水到碲化氢它们的稳定性依次减小,还原性和水溶液酸性依次增强.
ⅥA族的氢化物性质递变规律和ⅦA族氢化物的相似,同样因第一种元素的氢化物分子间形成氢键而性质有别于同族其它氢化物。

氧族含氧酸的K1值和Eθ值列于下表中。
|
含氧酸 |
电离常数
K1(298K) |
标准电极电势 |
Eθ/(V) |
|
H2SO3
H2SeO3
H2TeO3 |
1.5×10-2
2.4×10-3
2×10-3 |
H2SO3+4H++4e=S+3H2O
H2SeO3+4H++4e=Se+3H2O
TeO2+4H++4e=Te+2H2O |
0.45
0.74
0.53 |
|
H2SO4
H2SeO4
H6TeO6 |
完全电离(稀)
完全电离(稀)
6×10-7 |
SO42-+4H++2e=H2SO3+H2O
SeO42-+4H++2e=H2SeO3+H2O
H6TeO6+2H++2e=TeO2+4H2O |
0.172
1.15
1.02 |
氧化数为+Ⅳ的含氧酸,其酸性按H2SO3、H2SeO3、H2TeO3的顺序依次减弱。它们都具有氧化性和还原性。
氧化数为+Ⅵ的含氧酸,在稀溶液中,硫酸和硒酸都是强酸,而碲酸则是一种很弱的酸。硒酸和碲酸的氧化性比硫酸还强,是很强的氧化剂。

|