|
一:钒族元素基本性质 第ⅤB族即钒族包括钒、铌和钽三种元素,它们元素的基本性质见下表:
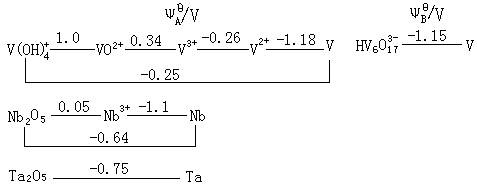
二:钒族元素的通性 钒族元素的价电子构型为(n-1)d3ns2,5个价电子都可以参与成键,因此它们的最高氧化态为+5,与族数一致,钒的+4氧化态最稳定,而铌和钽+5氧化态最稳定。 钒族自上而下,按钒、铌、钽的顺序,高氧化态的稳定性依次增强,而低氧化态的稳定性依次减弱。这一情况与d区其它元素相似,而与主族元素第ⅤA族刚好相反。 三:钒族元素电势图 钒族元素的标准电势图如下:
一:物理性质 钒是一种银灰色金属,铌、钽外形似铂,都有延展性,具有较高的熔点。钽是最难熔的金属之一。由于钒族各金属比同周期的钛族金属有较强的金属键,因此,它们的熔点,熔化热等都较相应的钛族金属为高。 二:化学性质 从标准电极电势看,钒族金属都是较强的还原剂,但由于金属表面容易形成钝化的氧化膜,使得钒族金属在室温下化学性质活泼性较低。如钒在常温下不与空气、水、酸、碱作用,但能溶于氢氟酸、浓硫酸、硝酸和王水中。铌和钽的化学稳定性特别高,尤其是钽,不仅不与空气和水作用,并且能抵抗除氢氟酸以外的所有无机酸甚至是王水的腐蚀。由此可看出:钒族金属从上到下金属活泼性逐渐减弱。 钒族金属都很容易溶解在硝酸和氢氟酸的混合酸中,并且都可以和熔融的苛性碱发生反应。在高温下也可与大多数非金属元素反应。 三:铌和钽的相似性* 铌和钽因原子半径和离子半径相似,化学性质也非常相似,给分离它们带来困难。若把它们的氧化物溶于氢氟酸,生成H2NbF7和H2TaF7配合物,其钾盐K2NbF7易水解生成K2NbOF5而K2TaF7不易水解,K2TaF7的溶解度比氟氧铌酸钾K2NbOF5小,利用此性质,调节溶液中HF的浓度,可使铌、钽分离。 目前常用溶剂萃取法,例如钽的化合物可被甲基异丁酮从稀的HF溶液中萃取出来,增加水溶液相的酸度可使铌的化合物被萃取到新的一批有机物相中去,以此达到分离的目的。 还可采用三甲基代丙酮为萃取剂,水相为H2NbOF5和H2TaF7的氢氟酸溶液,萃取剂:水相=1.62。萃取后,有机相中富集钽,用氨水反萃成Ta2O5·nH2O析出。水相中富集铌,用氨水后也析出Nb2O5·nH2O。该法适用于工业萃取,效果较好。 |