|
钒的主要氧化态有+Ⅴ,+Ⅳ,+Ⅲ,+Ⅱ,其中以+Ⅴ氧化态最稳定,其次是+Ⅳ氧化态,其它的都不稳定。由于氧化态为+Ⅴ的钒离子具有较大的电荷半径比,所以在水溶液中不存在简单的V5+离子,而是以钒氧基(VO2+、VO3+)或含氧酸根(VO3-、VO43-)等形式存在。同样,氧化态为+Ⅳ的钒在水溶液中也是以VO2+离子形式存在。

钒是一种银灰色金属,纯钒具有延展性,不纯时硬而脆。由于钒比同周期的钛有较强的金属键,因此,它的熔点,熔化热等都较相应的钛金属为高。
钒金属由于容易呈纯态,因此在常温下活泼性较低。块状钒在常温下不与空气、水、苛性碱作用,也不和非氧化性的酸作用,但溶于氢氟酸。它也溶于强的氧化性酸中,如硝酸和王水。在高温下,钒与大多数非金属元素反应,并可与熔融的苛性碱发生反应。钒可溶于硝酸和氢氟酸的混合酸中。

五氧化二钒呈橙黄色至深红色,无嗅,无味,有毒。它约在923K熔融,冷却时形成橙色针状晶体。它在迅速结晶时会因放出大量热而发光。五氧化二钒微溶于水,每100g水能溶解0.07gV2O5,溶液呈黄色。V2O5为两性偏酸的氧化物,因此易溶于碱溶液而生成钒酸盐。在强碱性溶液中,则能生成正钒酸盐M3VO4。
V2O5 + 6NaOH
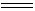 2Na3VO4 + 3H2O 2Na3VO4 + 3H2O
另一方面,V2O5也具有微弱的碱性,它能溶解在强酸中。在pH=1的酸性溶液中,能生成VO2+离子。从电极电势可以看出,在酸性介质中VO2+是一种较强的氧化剂。
VO2+
+ 2H+ + e- 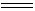 VO2+ + H2O
ψθ=1.0V
VO2+ + H2O
ψθ=1.0V
当五氧化二钒溶解在盐酸中时,钒(Ⅴ)能被还原成钒(Ⅳ)状态,并放出氯。
V2O5 +
6HCl 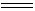 2VOCl2 + Cl2 + 3H2O 2VOCl2 + Cl2 + 3H2O
VO2+离子也可以被Fe2+,草酸、酒石酸和乙醇等还原剂还原为VO2+,
VO2+
+ Fe2+ + 2H+ 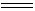 VO2+ + Fe3+ +
H2O
VO2+ + Fe3+ +
H2O
2VO2+
+ H2C2O4 + 2H+ 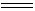 2VO2+
+ 2CO2 + 2H2O
2VO2+
+ 2CO2 + 2H2O
上述反应可用于氧化还原容量法测定钒。
V2O5用H2还原时,可制得一系列低氧化态氧化物,如深蓝色的二氧化钒VO2,黑色的三氧化二钒V2O3和黑色粉末状的一氧化钒VO等。

钒酸盐可分为偏钒酸盐MIVO3,正钒酸盐MI3VO4,焦钒酸盐MI4V2O7和多钒酸盐如MI3V3O9等。
在钒酸盐的酸性溶液中,加入还原剂(如锌粉),可以观察到溶液的颜色由黄色逐渐转变成蓝色、绿色、最后成紫色,这些颜色各对应于V(Ⅳ)、V(Ⅲ)和V(Ⅱ)的化合物。
向钒酸盐的溶液中加酸,使pH值逐渐下降,则生成不同缩合度的多钒酸盐。随着pH值的下降,多钒酸根中含钒原子越多,缩合度越大,其缩合平衡为:
2VO43-
+ 2H+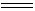 2HVO42- 2HVO42-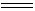 V2O74-
+ H2O (pH≥13) V2O74-
+ H2O (pH≥13)
3V2O74-
+ 6H+ 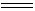 2V3O93- + 3H2O (pH≥8.4) 2V3O93- + 3H2O (pH≥8.4)
10V3O93-
+ 12H+ 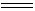 3V10O286- +
6H2O (8>pH>13) 3V10O286- +
6H2O (8>pH>13)
缩合度增大,溶液的颜色逐渐加深,即由淡黄色变到深红色。溶液转为酸性后,缩合度就不再改变,而是获得质子的反应。
[V10O28]6-
+ H+ 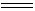 [HV10O28]5- [HV10O28]5-
[HV10O28]5-
+ H+ 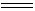 [H2V10O28]4- [H2V10O28]4-
在pH≈2时,则有五氧化二钒水合物的红棕色沉淀析出。如果加入足够的酸(pH=1),溶液中存在稳定的黄色VO2+离子。
[H2V10O28]4-
+ 14H+ 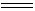 10VO2+ + 8H2O
(pH=1) 10VO2+ + 8H2O
(pH=1)
在钒酸盐的溶液中加入过氧化氢,若溶液是弱碱性,中性或弱酸性时,得到黄色的二过氧钒酸离子[VO2(O2)2]3-(也有认为是[VO2(H2O2)2]+离子,若溶液是强酸性时,得到红棕色的过氧钒阳离子
[V(O2)]3+(也有认为是[VO2(H2O2)2]+)离子,两者之间存在下列平衡:
[VO2(O2)2]3-
+ 6H+ 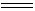 [V(O2)]3+ + H2O2
+ 2H2O [V(O2)]3+ + H2O2
+ 2H2O
钒酸盐与过氧化氢的反应,在分析上可作为鉴定钒和比色测定之用。

|