|
一:氮的氧化物的概况
氮和氧有多种不同的化合形式,在氧化物中氮的氧化态可以从+Ⅰ到+Ⅴ。其中以一氧化氮和二氧化氮较为重要。这些氧化物的物理性质和结构汇列下表中。
|
化学式 |
性状 |
熔点/K |
沸点/K |
结 构 |
|
N2O |
无色气体,尚稳定 |
182 |
184.5 |
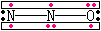
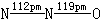
|
N以sp杂化轨道成键,形成2个σ键,2个π34键. |
|
NO |
气体,液体和固体都是无色 |
109.5 |
121 |
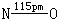
|
N以sp杂化轨道成键,形成1个σ键,1个π键,1个三电子π键. |
|
N2O3 |
蓝色固体,存在于低温;气态时分解为NO2和NO |
172.4 |
276.5(分解) |
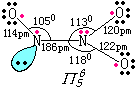
|
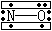
固态有两种构型,一为不稳定结构ONONO;一为稳定结构ONNO2,见左图(两个N均以sp2杂化成键,形成4个σ键,1个π56键). |
|
NO2 |
红棕色气体 |
264 |
294 |

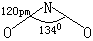
|
N以sp2杂化轨道成键,形成2个σ键,1个π33键. |
|
N2O4 |
无色气体 |
261.9 |
294.3 |
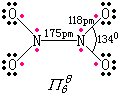
|
两个N均以sp2杂化轨道成键,形成5个σ键,1个π68键. |
|
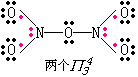
N2O5 |
无色固体,在漫射光和280K以下稳定,气体不稳定 |
305.6 |
(升华) |
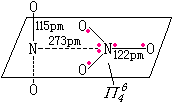
|
固体由NO2+NO3-离子组成,其结构如左图.NO2+是直线型的,而NO3-中三个O原子和中心N原子在同一平面上成三角形.
气体分子结构如左下图.两个N均以sp2杂化轨道成键,形成6个σ键,2个π34键. |
二:
一氧化氮
NO很容易与吸附在容器壁上的氧反应生成NO2。NO2又与NO结合生成N2O3:
NO + NO2  N2O3
N2O3
NO会形成二聚物,该反应是吸热反应。
2NO  N2O2 N2O2
NO微溶于水,但不与水反应,不助燃,在常温下极易与氧反应。由于分子中存在孤电子对,NO还可以同金属离子形成配合物,例如与FeSO4溶液形成棕色可溶性的硫酸亚硝酰合铁(Ⅱ).
FeSO4 + NO
 [Fe(NO)]SO4 [Fe(NO)]SO4
在反应中NO易失去π*2p轨道上的一个单电子形成亚硝酰正离子NO+,相应的化合物有NO+ClO4-、NO+HSO4-等。
三: 二氧化氮
二氧化氮是红棕色气体,易压缩成无色液体。N02是单电子分子,在低温时易聚合成二聚体N204。N2O4在固态时是无色晶体,由N02二聚体组成;在264K时熔解为黄色液体并含有少量NO2;当达到沸点时(294K),在棕色气体中含15%NO2。在413K以上N2O4全部转变为NO2,超过423K,NO2发生分解,
N2O4
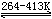 2NO2
△Hθ=57kJ·mol-1 2NO2
△Hθ=57kJ·mol-1
2NO2 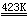 2NO +
O2
2NO +
O2
NO2易溶于水歧化生成HNO3和HNO2,而HNO2不稳定受热立即分解:
2NO2 + H2O
 HNO3 +
HNO2 HNO3 +
HNO2
3HNO2  HNO3 + 2NO +
H2O
HNO3 + 2NO +
H2O
所以当NO2溶于热水时其反应(上述两反应的合并)如下:
3NO2 + H2O(热)
 2HNO3 + NO 2HNO3 + NO
这个反应是工业上制备HNO3的一个重要反应。
NO2的氧化性较强,碳、硫、磷等在NO2中容易起火燃烧,它和许多有机物的蒸气混合可形成爆炸性气体。

一:亚硝酸 当将等物质的量的NO和NO2混合物溶解在冰水中或向亚硝酸盐的冷溶液中加酸时,生成亚硝酸:
NO + NO2 +
H2O  2HNO2 2HNO2
NaN02 +
H2SO4  HNO2 +
NaHSO4 HNO2 +
NaHSO4
亚硝酸很不稳定,仅存在于冷的稀溶液中,微热甚至冷时便分解为NO、NO2和H2O。
亚硝酸是一种弱酸,但比醋酸略强。
HNO2  H+ +
NO2- Ka=5×10-4(291K)
H+ +
NO2- Ka=5×10-4(291K)
在亚硝酸中,N的氧化数为+Ⅲ,处于中间状态,因此,它既可作氧化剂又可作还原剂,其氧化性比稀硝酸还强。无论在酸性还是碱性介质中,其氧化性都大于还原性,即亚硝酸的氧化性是主要的。
二:亚硝酸盐
除了浅黄色的微溶盐AgNO2外,一般亚硝酸盐易溶于水,水溶液是稳定的。亚硝酸盐,特别是碱金属和碱土金属的亚硝酸盐,都有很高的热稳定性。用粉末状金属铅、碳或铁在高温下还原固态硝酸盐,可得到亚硝酸盐,
Pb + KNO3
 KNO2 + PbO KNO2 + PbO
因亚硝酸盐中,氮原子的氧化态处于中间,因此既有氧化性又有还原性。亚硝酸盐在酸性溶液中是强氧化剂,氧化性是主要的;在碱性溶液中还原性是主要的,空气中的氧就能使NO2-氧化为NO3-。例如,NO2-在酸性溶液中能将I-氧化为单质碘,
2NO2- +
2I- + 4H+  2NO + I2 + 2H2O 2NO + I2 + 2H2O
这个反应可以定量地进行,能用于测定亚硝酸盐含量。用不同的还原剂,NO2-可被还原成NO、N2O、NH2OH、N2或NH3。当遇到更强氧化剂如KMnO4、Cl2等,亚硝酸盐则是还原剂,被氧化为硝酸盐,
2MnO4- +
5NO2- + 6H+  2Mn2+ + 5NO3- +
3H2O
2Mn2+ + 5NO3- +
3H2O
Cl2 + NO2- +
H20  2H+ + 2Cl- + N03- 2H+ + 2Cl- + N03-
NO2-离子是一种很好的配体,在氧原子和氮原子上都有孤电子对,它们能分别与金属离子形成配位键(如M←NO2和M←ONO),如NO2-与钴盐能生成钴亚硝酸根配离子[Co(NO2)6]3-,它与K+离子生成黄色K3[Co(NO2)6]沉淀,此方法可用于检出K+离子。

一:
硝酸
纯硝酸是无色液体,沸点356K,在231K下凝成无色晶体。硝酸和水可以按任何比例混合。恒沸点溶液含HNO3质量百分比为69.2%,沸点为394.8K,密度为1.42g·cm-3,约16mol/L,即一般市售的浓硝酸。浓硝酸受热或见光就按下式逐渐分解,使溶液呈黄色。
4HNO3 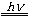 4NO2 +
O2 + 2H2O △rHθ=259.4kJ·mol-1
4NO2 +
O2 + 2H2O △rHθ=259.4kJ·mol-1
溶解了过量NO2的浓硝酸呈红棕色称为发烟硝酸。由于NO2起催化作用,反应被加速,所以发烟硝酸具有很强的氧化性。
硝酸的重要化学性质表现在以下两方面:
(1)作强氧化剂
硝酸为强氧化剂是由于HNO3中的氮处于最高氧化态以及硝酸分子不稳定易分解放出氧和二氧化氮所致。
非金属元素如碳、硫、磷。碘等都能被浓硝酸氧化成氧化物或含氧酸。
C + 4HNO3
 CO2 +
4NO2 + 2H2O CO2 +
4NO2 + 2H2O
S + 6HNO3
 H2SO4 +
6NO2 + 2H2O H2SO4 +
6NO2 + 2H2O
P + 5HNO3
 H3PO4 +
5NO2 + H2O H3PO4 +
5NO2 + H2O
3P + 5HNO3 +
2H2O  3H3PO4 + 5NO 3H3PO4 + 5NO
I2 +
10HNO3  2HIO3 +
10NO2 + 4H2O 2HIO3 +
10NO2 + 4H2O
3I2 +
10HNO3(稀)  6HIO3 + 10NO +
2H2O 6HIO3 + 10NO +
2H2O
除金、铂、铱、铑、钌、钛、铌、钽等金属外,硝酸几乎可氧化所有金属。某些金属如Fe、Al、Cr等能溶于稀硝酸,而不溶于冷浓硝酸。这是因为这类金属表面被浓硝酸氧化形成一层十分致密的氧化膜,阻止了内部金属与硝酸进一步作用,我们称这种现象为“钝态”;经浓硝酸处理后的“钝态”金属,就不易再与稀酸作用。
Sn、Sb、As、Mo、W和U等偏酸性的金属与HNO3反应后生成氧化物,其余金属与硝酸反应则生成硝酸盐。Mg、Mn和Zn与冷的稀硝酸(6mol·L-1~0.2mol·L-1)反应会放出H2。
硝酸作为氧化剂,可能被还原为以下一系列较低氧化态的氮的化合物.
硝酸被还原成为上述各种产物的可能性和倾向,仅凭电极电势是难以判断的,因为反应的实际情况往往还和动力学因素密切相关。例如,HNO3被还原为单质N2,其反应倾向很大(ψNO3-/N2=1.24V),但由于动力学原因却很少出现这个反应。
硝酸与金属反应,其还原产物中氧的氧化态降低了多少,主要取决于硝酸的浓度、金属的活泼性和反应的温度。
对同一种金属来说,酸愈稀则其还原产物氮的氧化态降低得愈多。一般地说,不活泼的金属如Cu、Ag、Hg和Bi等与浓硝酸反应主要生成NO2,与稀硝酸(6mol·L-1)反应主要生成NO;活泼金属如Fe,Zn、Mg等与稀硝酸反应则生成N2O或铵盐。
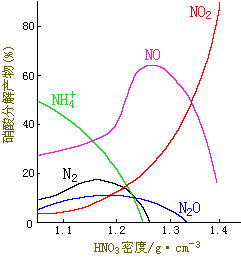 |
|
图13-10 HNO3与铁反应的还原产物 |
图13-10是铁与不同浓度HNO3反应时的还原产物,从图中可以看出,当其它条件一致时,例如温度与还原剂一致,在浓硝酸(密度为1.40g·cm-3)中,主要产物是NO2,随着HNO3浓度逐渐降低,产物NO2逐渐减少而NO的相对含量逐渐增多;当密度为1.30g·cm-3时,主要产物是NO,其次是NO2及少量N2O:当密度为1.15g·cm-3时,NO与NH4+的相对含量几乎相等;当HNO3的浓度降至密度为1.05g·cm-3时,NH4+离子成为主要产物。可见,凡有硝酸参加的反应都很复杂,往往同时生成多种还原产物。
浓硝酸与浓盐酸的混合液(体积比为1:3)称为王水,可溶解不能与硝酸作用的金属,如:
Au + HNO3
+ 4HCl  H[AuCl4] + NO + 2H2O H[AuCl4] + NO + 2H2O
3Pt + 4HNO3
+ 18HCl  3H2[PtCl6]
+ 4NO +
8H2O 3H2[PtCl6]
+ 4NO +
8H2O
金和铂能溶于王水,主要是由于王水中不仅含有HNO3、Cl2、NOCl等强氧化剂,
HNO3 + 3HCl
 NOCl +
Cl2 + 2H2O NOCl +
Cl2 + 2H2O
同时还有高浓度的氯离子,它与金属离子形成稳定的配离子如[AuCl4]-或[PtCl6]2-,从而降低了溶液中金属离子的浓度,有利于反应向金属溶解的方向进行。电对[AuCl4]-/Au的标准电极电势显然比电对Au3+/Au低得多,
Au3+ +
3e-  Au
φθ=1.42V Au
φθ=1.42V
[AuCl4]- +
3e-  Au +
4Cl- φθ=0.994V Au +
4Cl- φθ=0.994V
(2)硝化作用
硝酸以硝基(-NO2)取代有机化合物分子中的一个或几个氢原子,称为硝化作用。例如HNO3与苯反应而生成黄色油状的硝基苯。
这类反应是有机化学中极其重要的反应。在硝化过程中有水生成,因此浓H2SO4可以促进硝化作用的进行。
硝酸除了具有氧化性和硝化性外,它也是一种强酸,具有酸的一切特性,不过在稀硝酸中更显出酸的特征。
二: 硝酸盐
硝酸盐大多是无色易溶于水的晶体,它的水溶液没有氧化性。硝酸盐在常温下是较稳定的,但在高温时固体硝酸盐会分解放出02而显氧化性。硝酸盐热分解的产物决定于盐的阳离子。碱金属和碱土金属的硝酸盐热分解放出O2并生成相应的亚硝酸盐。电位顺序在Mg和Cu之间的金属所形成的硝酸盐热分解时生成相应的氧化物。电位顺序在铜以后的金属硝酸盐则分解为金属,例如;
2NaNO3  2NaNO2 +
O2
2NaNO2 +
O2
2Pb(NO3)2
 2PbO +
4NO2 + O2 2PbO +
4NO2 + O2
2AgNO3  2Ag +
2NO2 + O2
2Ag +
2NO2 + O2
由于各种金属的亚硝酸盐和氧化物稳定性不同,所以加热分解的最后产物也不同。 
|




