|
氮元素在形成化合物时的成键特征主要有以下三点:
1.氮可与电负性小的某些碱金属和碱土金属形成离子化合物。但必须指出这类化合物仅存于固态,遇水强烈水解,水溶液中不存在简单的N3-水合离子。
2.氮可与电负性大的非金属元素形成各种类型的共价化合物,在这些化合物中除通常遇到的共价单键、双键、叁键外,还形成不同类型的离域π键。形成多重键和离域π键是氮最突出的成键特点。
3.氮上的孤电子对,还容易进入过渡金属离子的空轨道,形成配位键,从而得到许多类型不同的配合物。
氮的这些成键特征和价键结构现总结在下表中,以供复习参考。
| 键 型 |
结构图式 |
σ键数目 |
π键 |
孤电子对数 |
分子形状 |
化合物举例 |
| 类型 |
数目 |
| 离子键 |
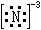 |
- |
- |
- |
- |
- |
Li3N,Mg3N2 |
| 共
价
键 |
成
键
轨
道 |
sp3 |
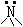 |
3 |
0 |
0 |
1 |
三角锥 |
NH3,NCl3 |
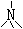 |
4 |
0 |
0 |
0 |
正四面体 |
NH4+ |
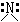 |
2 |
0 |
0 |
2 |
角形 |
NH2- |
| sp2 |
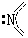 |
2 |
π33 |
1 |
1 |
角形 |
NO2 |
| 2 |
π34 |
1 |
0 |
|
NO2- |
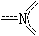 |
3 |
π46 |
1 |
0 |
平面三角形 |
NO3- |
| sp |
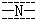 |
2 |
π34 |
2 |
0 |
直线 |
NO2+,N2O |
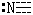 |
1 |
π22 |
2 |
1 |
直线 |
N2 |
| 配位键 |
←:NH3 |
许多过渡金属的氨合物,胺合物 |
| ←:NO2 |
过渡金属的硝基配合物,如Co(NO2)63- |
| ←:N2 |
某些过渡金属的分子氮合物,如[Os(NH3)5N2]2+ |

氮是无色无臭的气体,熔点为63K,沸点为77K,临界温度为126K。因此,它是难于液化的气体。N2在水中溶解度很小,常压下283K时水可溶解N2的体积比大约为1:O.02。N2在常温下就和锂直接反应生成Li3N, 在高温时不但能和镁、钙、铝、硼、硅等化合生成氮化物,而且能与氧、氢直接化合。因N的原子半径小又没有d轨道可供成键,所以N在化合物中的配位数最多不超过4。
N2 + 6Li  2Li3N 2Li3N
N2 + 3Ca  Ca3N2 Ca3N2
N2 + 2B  2BN(原子晶体) 2BN(原子晶体)
N2 + O2  2NO 2NO

一:氨
氨是一种有刺激臭味的无色气体。它在常温下很容易被加压液化。氨有较大的蒸发热(在沸点时为236kJ·mol-1),因此,常用它来作冷冻机的循环致冷剂。氨极易溶于水,在常压下293K时水可溶解氨的体积比为1:700.
氨水的密度小于1g·cm-3(纯液氨在243K时的密度为0.6777g·cm-3). 氨含量越多,密度越小. 一般市售浓氨水的密度为0.88g·cm-3,含氨质量百分比约28%。氨分子具有极性,液氨的分子间存在着强的氢键,故在液氨中存在缔合分子。液氨的介电常数(在239K时约为22F·m-1)比水(在298K时为81F·m-1)低得多,是有机化合物的较好溶剂,溶解离子型的无机物则不如水.液氨的自电离为:
2NH3  NH4+ +
NH2- K=1.9×10-30(223K)
NH4+ +
NH2- K=1.9×10-30(223K)
金属在液氨中的活性比在水中低,很浓的碱金属液氮溶液是强还原剂,可与溶于液氮的物质发生均相的氧化还原反应,
氨的主要化学性质有以下几方面:
(1)还原性:
氨能还原多种氧化剂。常温下,氨在水溶液中能被许多强氧化剂(Cl2,H2O2,KMnO4等)所氧化,例如:
3Cl2 +
2NH3  N2 + 6HCl N2 + 6HCl
苦Cl2过量则得NCl3.
3Cl2 +
NH3  NCl3 + 3HCl NCl3 + 3HCl
(2)取代反应:
取代反应的一种形式是氨分子中的氢被其它原子或基团所取代,生成一系列氨的衍生物。如氨基-NH2的衍生物,亚氨基=NH的衍生物或氮化物N≡。取代反应的另一种形式是氨以它的氨基成亚氨基取代其它化合物中的原子或基团,例如:
HgCl2 +
2NH3  Hg(NH2)Cl +
NH4Cl Hg(NH2)Cl +
NH4Cl
COCl2(光气) +
4NH3  CO(NH2)2(尿素) +
2NH4Cl CO(NH2)2(尿素) +
2NH4Cl
这种反应与水解反应相类似,实际上是氨参与的复分解反应.称为氨解反应. 二:
氨盐
铵盐一般是无色的晶体,易溶于水。由于氨的弱碱性,铵盐都有一定程度的水解,由强酸组成的铵盐其水溶液显酸性。
NH4+ +
H2O  NH3·H2O +
H+ NH3·H2O +
H+
因此,在任何铵盐溶液中,加入强碱并加热,就会释放出氨(检验铵盐的反应).
NH4+ +
OH-  NH3 + H2O NH3 + H2O
铵盐的另一重要性质是对热的不稳定性。固态铵盐加热时极易分解,一般分解为氨和相应的酸。
NH4HCO3
 NH3 +
CO2 + H2O NH3 +
CO2 + H2O
NH4Cl  NH3
+ HCl
NH3
+ HCl
如果酸是不挥发性的,则只有氨挥发逸出,而酸或酸式盐则残留在容器中。
(NH4)2SO4
 NH3 +
NH4HSO4 NH3 +
NH4HSO4
(NH4)3PO4
 3NH3 +
H3PO4 3NH3 +
H3PO4
如果相应的酸有氧化性,则分解出来的NH3会立即被氧化。例如NH4NO3,由于硝酸有氧化性,因此受热分解时,氨被氧化为一氧化二氮。
NH4NO3
 N2O +
2H2O N2O +
2H2O
如果加热温度高于573K,则一氧化二氮又分解为N2和O2。
2NH4NO3
 4H2O +
2N2 + O2 △rHθ=-238.6 kJ·mol-1 4H2O +
2N2 + O2 △rHθ=-238.6 kJ·mol-1
由于这个反应生成大量的气体并放出大量的热,气体受热体积迅速膨胀,所以如果反应是在密闭容器中进行,就会发生爆炸。基于这种性质,NH4NO3可用于制造炸药。
总之,铵盐的热分解就是NH4+离子把质子转移给酸根的反应。构型相同的铵盐,若生成它们的酸愈弱(这些酸无氧化性)则铵盐的热稳定性愈差。例如,卤化铵的热稳定性是按HI—HBr—HCl—HF的顺序而递减。

纯联氨是一种可燃性的液体,它在空气中发烟,能与水及酒精无限混合。在加热时联氨便发生爆炸性的分解。它在空气中燃烧放出大量的热。
N2H4(l) +
O2(g)  N2(g) +
2H2O(1) △rHθ=-624 kJ·mol-1 N2(g) +
2H2O(1) △rHθ=-624 kJ·mol-1
它的烷基衍生物可作为火箭的燃料。
联氨可以接受两个质子而显碱性,是二元弱碱,碱性稍弱于氨。
N2H4 +
H2O  N2H5+ +
OH- K1=1.0×10-6(298K) N2H5+ +
OH- K1=1.0×10-6(298K)
N2H5+ +
H2O  N2H62+ +
OH- K2=9.0×10-16(298K) N2H62+ +
OH- K2=9.0×10-16(298K)
它生成的两类盐中,一价酸根的盐如N2H5Cl较稳定,而N2H62+离子所生成的盐均易水解.
联氨是一种强还原剂,在碱性溶液中能将CuO、IO3-、Cl2、Br2等还原,本身被氧化为N2。
4CuO + N2H4
 2Cu2O +
N2 + 2H2O 2Cu2O +
N2 + 2H2O
2IO3- +
3N2H4  2I- +
3N2 + 6H2O
2I- +
3N2 + 6H2O
随着参加反应的氧化剂不同,N2H4的氧化产物除了N2,还有NH4+和HN3。
2MnO4- +
10N2H5+ + 6H+  10NH4+ +
5N2 + 2Mn2+ + 8H2O
10NH4+ +
5N2 + 2Mn2+ + 8H2O
N2H5+ +
HNO2  HN3 +
H+ + 2H2O HN3 +
H+ + 2H2O

纯羟氨是无色固体,熔点305K,不稳定,在288K以上便分解为NH3、N2和H2O
3NH2OH
 NH3 +
N2 + 3H2O NH3 +
N2 + 3H2O
4NH2OH
 2NH3 +
N2O + 3H2O(部分按此式分解) 2NH3 +
N2O + 3H2O(部分按此式分解)
羟氨易溶于水,它的水溶液比较稳定显弱碱性(比联氨还弱).
NH2OH +
H2O  NH3OH+ +
OH- K=6.6×10-9(298K) NH3OH+ +
OH- K=6.6×10-9(298K)
它与酸形成盐,常见的盐有[NH3OH]Cl和[NH3OH]2SO4。
将较高氧化态的含氮化合物还原,可制得羟氨,如把亚硝酸盐还原为羟氨的盐.
NH4NO2 +
NH4HSO3 + SO2 + 2H20  [NH3OH]+HSO4- +
(NH4)2SO4
[NH3OH]+HSO4- +
(NH4)2SO4
羟氨既有还原性又有氧化性,但它主要用作还原剂。羟氨与联氨作为还原剂的优点,一方面是它们具有强的还原性,另一方面是它们的氧化产物主要是气体(N2,N2O,NO),可以脱离反应体系,不会给反应体系带来杂质。

氮在高温时能与许多金属或非金属反应而生成氮化物如:
3Mg + N2  Mg3N2 2B + N2
Mg3N2 2B + N2
 2BN 2BN
ⅠA、ⅡA族元素的氮化物属于离子型,可以在高温时由金属与N2直接化合,也可用加热氨基化物的方法而制备:
3Ba(NH2)2
 Ba3N2 +
4NH3 Ba3N2 +
4NH3
这类氮化物大多是固体,化学活性大,遇水即分解为氨与相应的碱,
Li3N +
3H2O  3LiOH +
NH3 3LiOH +
NH3
ⅢA、ⅣA族的氮化物如BN, AlN, Si3N4、Ge3N4是固态的聚合物,其中BN、AlN为巨型分子具有金刚石型结构,熔点很高(2273~3273K),它们一般是绝缘体或半导体。
过渡金属的氮化物如TiN, ZrN, Mn5N2、W2N3等不能看作是氨的简单取代产物,它们属于“间充化合物”,氮原子填充在金属结构的间隙中。这类氮化物化学性质稳定,一般不易与水、酸起反应,不被空气中的氧所氧化,具有金属的外形,热稳定性高,能导电并具有高熔点和高硬度(在9~10之间). 由于它们具有这些特性,因此适合用于作高强度的材料。

氢叠氮酸为无色有刺激味的液体,沸点308.8K,熔点193K。它是易爆物质,只要受到撞击就立即爆炸而分解。
2HN3
 3N2 +
H2 △rHθ=-593.6kJ·mol-1 3N2 +
H2 △rHθ=-593.6kJ·mol-1
因为HN3的挥发性高,可用稀H2SO4与NaN3作用制备HN3:
NaN3 + H2SO4
 NaHSO4 +
HN3 NaHSO4 +
HN3
NaN3可从下面反应得到:
3NaNH2 +
NaNO3  NaN3 + 3NaOH +
NH3 NaN3 + 3NaOH +
NH3
HN3的水溶液为一元弱酸(K=1.9×10-5),它与碱或活泼金属作用生成叠氮化物。
HN3 + NaOH
 NaN3 +
H2O NaN3 +
H2O
2HN3 + Zn
 Zn(N3)2 +
H2 Zn(N3)2 +
H2
HN3中N的氧化态为-1/3,所以它既显氧化性又显还原性。HN3的水溶液会发生歧化分解。
HN3 + H20
 NH2OH +
N2 NH2OH +
N2
活泼金属如碱金属和钡等的叠氮化物,加热时不爆炸,分解为氮和金属。
2NaN3(s)
 2Na(l) +
3N2(g) 2Na(l) +
3N2(g)
加热LiN3则转变为氮化物。象Ag、Cu、Pb、Hg等的叠氮化物加热就发生爆炸,基于这一性质,Pb(N3)2和Hg(N3)2可做为雷管的起爆剂。

|